Hvis natrium har en elektron i sin ydre skal og klor syv, vil de have en ionisk overføringsbinding eller dele binding?
* natrium (NA) Har en elektron i sin yderste skal. Den ønsker at miste dette elektron for at opnå en stabil, fyldt ydre skal som de ædle gasser.
* klor (Cl) Har syv elektroner i sin yderste skal. Den ønsker at få et elektron for at opnå en stabil, fyldt ydre skal.
Overførslen:
Natrium mister let sin ene elektron for at blive en positivt ladet ion (Na+). Klor vinder let, at elektronet bliver en negativt ladet ion (CL-). De modsatte anklager tiltrækker hinanden stærkt og danner en ionisk binding.
Nøglepunkter:
* ioniske bindinger Involver fuldstændig overførsel af elektroner fra et atom til et andet, hvilket skaber modsat ladede ioner, der tiltrækkes af hinanden.
* Deling af obligationer (kovalente bindinger) involverer atomer, der deler elektroner for at opnå stabile ydre skaller.
Fortæl mig, hvis du gerne vil have flere detaljer om ioniske eller kovalente bindinger!
Sidste artikelEr nitrogentrifluorid en hydrogenbinding?
Næste artikelKan et element repræsenteres som en kemisk formel?
 Varme artikler
Varme artikler
-
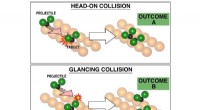 Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar
Kemikere fremmer evnen til at kontrollere kemiske reaktionerValget af påvirkningsparameteren er grundlæggende for resultatet af kemisk reaktion, som visualiseret her baseret på eksperimenter. Ved nul indvirkningsparameter, reaktionen øverst viste reproducerbar -
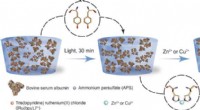 Kation-induceret formprogrammering og morphing i proteinbaserede hydrogelerSkema af fikseringsprocessen. (Venstre) BSA-baserede proteinhydrogeler fremstilles ved hjælp af en lysaktiveret reaktion, i nærværelse af ammoniumpersulfat (APS) og tris(bipyridin) ruthenium(II)chlori
Kation-induceret formprogrammering og morphing i proteinbaserede hydrogelerSkema af fikseringsprocessen. (Venstre) BSA-baserede proteinhydrogeler fremstilles ved hjælp af en lysaktiveret reaktion, i nærværelse af ammoniumpersulfat (APS) og tris(bipyridin) ruthenium(II)chlori -
 Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ
Forskning ser på materialets friktionsegenskaberSandia National Laboratories forskere Michael Chandross, venstre, og Nicolas Argibay viser en computersimulering og et ultrahøjt vakuum tribometer brugt til friktions- og slidtest, som er blandt de væ -
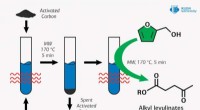 Chemist foreslår ny måde at forbedre brændstofkvaliteten ved hjælp af mikrobølgebestrålingKredit:RUDN Universitet En kemiker fra RUDN University har fundet en miljøvenlig måde at opnå estere af levulinsyre, der bruges som brændstoftilsætningsstof til kemisk syntese. Sammen med kolleger
Chemist foreslår ny måde at forbedre brændstofkvaliteten ved hjælp af mikrobølgebestrålingKredit:RUDN Universitet En kemiker fra RUDN University har fundet en miljøvenlig måde at opnå estere af levulinsyre, der bruges som brændstoftilsætningsstof til kemisk syntese. Sammen med kolleger


