Hvad er reaktionen, når du blander kobberchlorid og ammoniumhydroxid?
reaktion:
Cucl₂ (aq) + 4nh₄oh (aq) → [cu (nh₃) ₄] ²⁺ (aq) + 2cl⁻ (aq) + 4h₂o (l)
Forklaring:
1. starttilstand: Kobberchlorid (Cucl₂) opløses i vand til dannelse af kobber (II) -ioner (Cu²⁺) og chloridioner (Cl⁻). Ammoniumhydroxid (NH₄OH) er en svag base, der findes i ligevægt med ammoniak (NH₃) og vand.
2. Dannelse af tetraamminecopper (II) ion: Når ammoniumhydroxid tilsættes, reagerer ammoniakmolekyler (NH₃) fra ligevægten med kobber (II) -ioner for at danne en kompleks ion kaldet tetraamminecopper (II) ion ([Cu (NH₃) ₄] ²⁺). Denne komplekse ion er en dyb blå farve.
3. nedbør: Efterhånden som der tilsættes mere ammoniumhydroxid, øges koncentrationen af ammoniak, hvilket favoriserer dannelsen af TetraammineCopper (II) -komplekset. Imidlertid øges koncentrationen af chloridioner også, og i overskydende ammoniak reduceres opløseligheden af komplekset. Dette fører til nedbør af et lyseblå fast stof, som sandsynligvis er en blanding af [Cu (NH₃) ₄] cl₂ og [Cu (NH₃) ₄] (OH) ₂.
Observationer:
* Oprindeligt drejer opløsningen en lyseblå, når TetraammineCopper (II) -kompleksformerne.
* Efterhånden som der tilsættes mere ammoniumhydroxid, bliver opløsningen en dybere blå.
* Et lyseblå bundfald vil til sidst dannes, hvilket indikerer dannelsen af det uopløselige kobberkompleks.
Bemærk: Reaktionen er reversibel. Hvis du tilsætter en stærk syre, såsom saltsyre, til opløsningen, skifter ligevægten tilbage mod dannelsen af kobber (II) -ioner, og den blå farve forsvinder.
 Varme artikler
Varme artikler
-
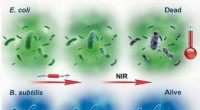 Selektiv fototermisk behandling med supramolekylære radikale anioner genereret in situKredit:Wiley En ny fototermisk behandling kan hjælpe med at overvinde antibiotikaresistens. I denne metode, en agent omdanner nær-infrarødt lys til lokal opvarmning, som dræber patogenerne. Imidle
Selektiv fototermisk behandling med supramolekylære radikale anioner genereret in situKredit:Wiley En ny fototermisk behandling kan hjælpe med at overvinde antibiotikaresistens. I denne metode, en agent omdanner nær-infrarødt lys til lokal opvarmning, som dræber patogenerne. Imidle -
 Forskere opdager en ny klasse af halvledende entropistabiliserede materialerKrystalstruktur af GeSnPbSSeTe, en halvledende entropistabiliseret chalcogenidlegering. De gule atomer er kationer (Ge, Sn, Pb) og de blå atomer er anioner (S, Se, Te). Forskellen i lethed svarer til
Forskere opdager en ny klasse af halvledende entropistabiliserede materialerKrystalstruktur af GeSnPbSSeTe, en halvledende entropistabiliseret chalcogenidlegering. De gule atomer er kationer (Ge, Sn, Pb) og de blå atomer er anioner (S, Se, Te). Forskellen i lethed svarer til -
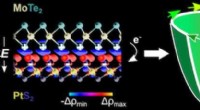 Teori kunne fremskynde skub for spintroniske enhederbilledet til venstre viser krystalstrukturen af et MoTe2|PtS2 heterobillag med isocharge plots fra en model skabt på Rice University. Når materialerne stables sammen, spejlsymmetri er brudt, og der
Teori kunne fremskynde skub for spintroniske enhederbilledet til venstre viser krystalstrukturen af et MoTe2|PtS2 heterobillag med isocharge plots fra en model skabt på Rice University. Når materialerne stables sammen, spejlsymmetri er brudt, og der -
 Miniaturiseret neuroprobe til prøvetagning af neurotransmittere i hjernenMathieu Odijk og kollega Loes Segerink. Kredit:University of Twente Forskere ved University of Twente har designet en lille nål, hvori mikrokanaler kan bruges til at udvinde små væskeprøver fra et
Miniaturiseret neuroprobe til prøvetagning af neurotransmittere i hjernenMathieu Odijk og kollega Loes Segerink. Kredit:University of Twente Forskere ved University of Twente har designet en lille nål, hvori mikrokanaler kan bruges til at udvinde små væskeprøver fra et
- Robotter lærer at arrangere objekter ved at 'hallucinere' mennesker ind i deres miljø (m/ video)
- Guld brugt som sikker driver af kræftmedicin
- Løsning af vigtige observationsproblemer i sporing af finskala ændringer af vores planet fra rumme…
- Dynamisk gating-proces observeret ved hastigheder under 2 nm i nanokanaler
- Nye strukturelle detaljer om det specifikke arrangement af atomer i konjugerede polymerer
- Egenskaber, der påvirker smelte- og kogepunkterne i et molekyle?


