Hvorfor findes fluor som et diatomisk molekyle?
* Høj elektronegativitet: Fluor er det mest elektronegative element på den periodiske tabel. Dette betyder, at det har en stærk tendens til at tiltrække elektroner.
* lille atomstørrelse: Fluor har en meget lille atomradius, hvilket resulterer i en stærk overlapning af atomiske orbitaler, når to fluoratomer kommer tæt på hinanden.
* Dannelse af en stærk kovalent binding: Den stærke overlapning af atomiske orbitaler fører til dannelse af en meget stærk kovalent binding mellem to fluoratomer. Denne binding er så stærk, at det er vanskeligt at bryde, hvilket gør F₂ til et stabilt molekyle.
Her er en mere detaljeret forklaring:
1. Elektronegativitet: Fluorens høje elektronegativitet betyder, at den ønsker at få et elektron for at opnå en stabil oktetkonfiguration. Imidlertid kan et enkelt fluoratom ikke opnå dette på egen hånd.
2. Ved at danne en kovalent binding med et andet fluoratom kan hvert atom dele en elektron, afslutte sin oktet og opnå stabilitet. Denne deling af elektroner skaber en stærk kovalent binding.
3. obligationsstyrke: Den lille størrelse af fluoratomer muliggør betydelig overlapning af deres atomiske orbitaler, hvilket fører til en meget stærk kovalent binding. Denne stærke binding bidrager til stabiliteten af F₂ -molekylet.
Sammenfattende gør kombinationen af fluorens høje elektronegativitet, lille atomstørrelse og den resulterende stærke kovalente binding den diatomiske form (F₂) den mest stabile og foretrukne form for fluor.
 Varme artikler
Varme artikler
-
 Bioaktive naturlige forbindelser til kampen mod kræftSojaplanter producerer glyceolliner som reaktion på patogenangreb såsom svampe, bakterier eller UV-bestråling, for at bevare deres helbred. Kredit:pixabay.com Phytoalexiner er bioaktive fytokemika
Bioaktive naturlige forbindelser til kampen mod kræftSojaplanter producerer glyceolliner som reaktion på patogenangreb såsom svampe, bakterier eller UV-bestråling, for at bevare deres helbred. Kredit:pixabay.com Phytoalexiner er bioaktive fytokemika -
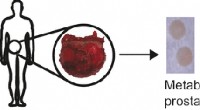 Glykaner som biomarkører for kræft?Kredit:Wiley Glykosylerede proteiner er ofte overudtrykt i tumorceller og kan derfor tjene som tumormarkører, især dem med det interessante molekyle sialinsyre som sukkerdel. I journalen Angewand
Glykaner som biomarkører for kræft?Kredit:Wiley Glykosylerede proteiner er ofte overudtrykt i tumorceller og kan derfor tjene som tumormarkører, især dem med det interessante molekyle sialinsyre som sukkerdel. I journalen Angewand -
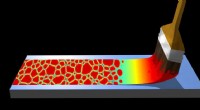 Beregning af den bedste fremstillingsstrategi for organiske elektroniske komponenterVed hjælp af computersimuleringer, MPI-P-forskere kan forudsige strukturen af krystaller i organiske halvlederlag. Kredit:Max Planck Society Halvledere lavet af organiske materialer, f.eks. til
Beregning af den bedste fremstillingsstrategi for organiske elektroniske komponenterVed hjælp af computersimuleringer, MPI-P-forskere kan forudsige strukturen af krystaller i organiske halvlederlag. Kredit:Max Planck Society Halvledere lavet af organiske materialer, f.eks. til -
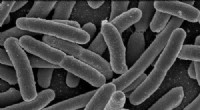 Forskere udvikler meget nøjagtige sensorer til E. coli-risikodetekteringEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere ved CU Boulder har udviklet og valideret en ny sensor til E. coli-risikodetektering, der har en imponerende 83 % nøjagtighe
Forskere udvikler meget nøjagtige sensorer til E. coli-risikodetekteringEscherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH Forskere ved CU Boulder har udviklet og valideret en ny sensor til E. coli-risikodetektering, der har en imponerende 83 % nøjagtighe


