Hvad er den empiriske formel for et sammensat uran og fluor, der er sammensat 67,6 procent 32,4 er?
1. Antag en 100 g prøve
* Dette gør beregningerne lettere. Vi har nu 67,6 g uran (U) og 32,4 g fluor (F).
2. Konverter gram til mol
* Opdel massen af hvert element med dets molære masse:
* uran (U): 67,6 g / 238,03 g / mol =0,284 mol
* fluor (F): 32,4 g / 19,00 g / mol =1,71 mol
3. Find molforholdet
* Opdel hver molværdi med den mindste molværdi:
* uran (U): 0,284 mol / 0,284 mol =1
* fluor (F): 1,71 mol / 0,284 mol =6,03 ≈ 6
4. Skriv den empiriske formel
* Molforholdet fortæller os, at det enkleste forhold mellem hele nummeret mellem atomer i forbindelsen.
* Den empiriske formel er uf₆ (uranhexafluorid).
Sidste artikelHar brintgas nogen farve?
Næste artikelEr natriumchlorationisk eller kovalent?
 Varme artikler
Varme artikler
-
 Forskere giver indsigt i letvægtsmateriale, der udvider sig med varmeKredit:Chong Min Koos gruppe ved Korea Institute of Science and Technology (KIST) Når det kommer til at tage plads uden at lægge for meget vægt, boblen kan ikke slås. Fordi de for det meste er luf
Forskere giver indsigt i letvægtsmateriale, der udvider sig med varmeKredit:Chong Min Koos gruppe ved Korea Institute of Science and Technology (KIST) Når det kommer til at tage plads uden at lægge for meget vægt, boblen kan ikke slås. Fordi de for det meste er luf -
 Ændringer i bakteriecellevæggen producerer flere fedtmolekylerForskere undersøgte de systemer, der kontrollerer lipidproduktionen i bakterien Rhodobacter sphaeroides for at øge lipidproduktionen til industriel brug. Kredit:DOEs Environmental Molecular Sciences L
Ændringer i bakteriecellevæggen producerer flere fedtmolekylerForskere undersøgte de systemer, der kontrollerer lipidproduktionen i bakterien Rhodobacter sphaeroides for at øge lipidproduktionen til industriel brug. Kredit:DOEs Environmental Molecular Sciences L -
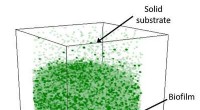 Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm
Ind i det molekylære øje:Undersøgelse af flydende prøver i realtidEt 3D-molekylær ionbillede giver forskere mulighed for at spore en PO 3 arter i en levende biofilm, der vokser under et fast substrat. Kredit:Environmental Molecular Sciences Laboratory Biofilm -
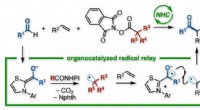 Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupperEt japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller el
Vicinal reaktion:En radikal strategi for sammenkædning af tre organiske grupperEt japansk forskerteam ved Kanazawa University udviklede en reaktion for at skabe funktionaliserede ketoner. Ved hjælp af en N-heterocyklisk carbene (NHC) organokatalysator, uden behov for metaller el
- Disse 7 elementer danner molekyler sammensat af 2 atomer hver, når de ikke er en forbindelse?
- Fjendtlige lærere kan miste elever 5 procent på testresultater
- Geotekstiler kan bremse gletsialsmelten, men til hvilken pris?
- Metamaterialefliser øger følsomheden for store teleskoper
- Hvad er den elektromagnetiske stråling på 101,8mhz?
- Hvilken teori forklarer sandsynligvis, hvordan månen blev dannet?


