Når 100 cm3 af 1,0 molært natriumhydroxidopløsning ved 200C blev tilsat til HCl, beregner temperaturen 26,80C standardvarme neutralizati?
1. Beregn den varme, der er absorberet af opløsningen:
* Specifik varmekapacitet af vand: Antag, at opløsningen har den samme specifikke varmekapacitet som vand (4.184 J/g ° C).
* Massen af løsningen: Vi antager, at densiteten af opløsningen er tæt på vandet (1 g/ml). Da vi har 100 cm³ (som er lig med 100 ml), er massen ca. 100 g.
* Temperaturændring: ΔT =26,8 ° C.
* optaget af varme (q) =masse × specifik varmekapacitet × ΔT
* Q =100 g × 4,184 J/g ° C × 26,8 ° C
* Q =11200 J ≈ 11,2 kJ
2. Beregn molen af NaOH:
* Molaritet af NaOH: 1,0 m
* Volumen NaOH: 100 cm³ =0,1 l
* mol NaOH =molaritet × Volumen
* Mol NaOH =1,0 m × 0,1 l =0,1 mol
3. Beregn standardvarmen for neutralisering (ΔH):
* ΔH =-q / mol NaOH (Det negative tegn skyldes, at reaktionen frigiver varme, hvilket betyder, at den er eksoterm)
* ΔH =-11,2 kJ / 0,1 mol
* ΔH =-112 kJ/mol
Derfor er standardvarmen for neutralisering til reaktionen af NaOH og HCI ca. -112 kJ/mol.
Vigtige noter:
* Denne beregning antager, at reaktionen går på færdiggørelse, hvilket betyder, at alle NaOH og HCL reagerer på dannelse af vand og salt.
* I virkeligheden kan neutraliseringsvarmen variere lidt afhængigt af de specifikke koncentrationer af reaktanterne og omgivelsens temperatur.
* Denne beregning er en tilnærmelse. For mere præcise resultater skal du overveje varmekapaciteten af den kalorimeter, der bruges til at udføre eksperimentet, og redegøre for eventuelle varmetab til omgivelserne.
 Varme artikler
Varme artikler
-
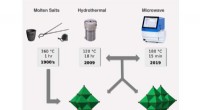 Energilagringsmaterialer bygget af molekylære blokke i nanostørrelseOversigt over forskellige fremgangsmåder til fremstilling af niobium- og tantalpolyoxometalationer og hvornår de blev rapporteret. Kredit:Tilpasset fra Rambaran et al. Molekyler af det sjældne meta
Energilagringsmaterialer bygget af molekylære blokke i nanostørrelseOversigt over forskellige fremgangsmåder til fremstilling af niobium- og tantalpolyoxometalationer og hvornår de blev rapporteret. Kredit:Tilpasset fra Rambaran et al. Molekyler af det sjældne meta -
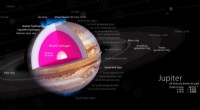 Franske forskere hævder at have skabt metallisk brintDenne udskæring illustrerer en model af det indre af Jupiter, med en stenet kerne dækket af et dybt lag flydende metallisk brint. Kredit:Kelvinsong/Wikimedia Commons Forskere har længe spekuleret
Franske forskere hævder at have skabt metallisk brintDenne udskæring illustrerer en model af det indre af Jupiter, med en stenet kerne dækket af et dybt lag flydende metallisk brint. Kredit:Kelvinsong/Wikimedia Commons Forskere har længe spekuleret -
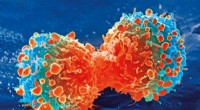 Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle
Avanceret kræftlægemiddel krymper og interkalerer DNAKræftcelle under celledeling. Kredit:National Institutes of Health På grund af de skadelige bivirkninger af kemoterapi, og den stigende resistens over for lægemidler, der findes i mange kræftcelle -
 Havforurening:Hvordan fortyndes plasttilsætningsstoffer i vand, og hvor risikable er de?Plastaffald kan forurene vandforsyningen, da det nedbrydes til mikroplast, og dets tilsætningsstoffer udvaskes. Disse tilsætningsstoffer indeholder nogle gange skadelige kemikalier, som ophobes i milj
Havforurening:Hvordan fortyndes plasttilsætningsstoffer i vand, og hvor risikable er de?Plastaffald kan forurene vandforsyningen, da det nedbrydes til mikroplast, og dets tilsætningsstoffer udvaskes. Disse tilsætningsstoffer indeholder nogle gange skadelige kemikalier, som ophobes i milj
- Forklarer:Sådan løser du et juveltyveri (og hvorfor det tager så lang tid)
- Hvem har været på månen to gange?
- Hvorfor blæser ventilatoren på min varme luftovn kold luft?
- Hvilken rækkefølge vil sandgrussten og jord i vand?
- Havbølger efter tab af havis udløser kollaps af den antarktiske ishylde
- Undersøgelse viser naturgas, vind og sol er de billigste teknologier til elproduktion


