Hvad er den komplette redoxreaktion for MnO4- og H2O2 under syrebetingelser?
1. Identificering af halvreaktioner:
* Oxidation Halvreaktion: H2O2 → O2 + 2H + + 2E-
* Hydrogenperoxid (H2O2) oxideres til iltgas (O2).
* reduktion halvreaktion: MnO4- + 8H + + 5E- → Mn2 + + 4H2O
* Permanganation (MnO4-) reduceres til mangan (II) ion (Mn2+).
2. Afbalancering af antallet af elektroner:
* Multiplicer oxidationen halvreaktion med 5 og reduktionen halvreaktion med 2 for at udligne antallet af overførte elektroner:
* 5H2O2 → 5O2 + 10H + + 10E-
* 2MNO4- + 16H + + 10E- → 2MN2 + + 8H2O
3. Kombination af halvreaktionerne:
* Tilføj de to afbalancerede halvreaktioner sammen. Bemærk, at elektronerne annullerer:
* 5H2O2 + 2MNO4- + 16H + + 10E- → 5O2 + 10H + + 10E- + 2MN2 + + 8H2O
4. Forenkling af ligningen:
* Annuller de fælles udtryk på begge sider:
* 5H2O2 + 2MNO4- + 6H + → 5O2 + 2MN2 + + 8H2O
Komplet redoxreaktion:
Den komplette afbalancerede redoxreaktion for reaktionen af permanganation (MNO4-) og hydrogenperoxid (H2O2) i sur opløsning er:
5H2O2 + 2MNO4- + 6H + → 5O2 + 2MN2 + + 8H2O
Sidste artikelSkriv opløselighedsproduktudtrykket for sølvchromat.?
Næste artikelReaktion af Na2S2O5 plus H2O2 og pH -effekt?
 Varme artikler
Varme artikler
-
 West Virginia forskere bruger neutroner til at studere materialer til forbedringer af kraftværkerForskere fra West Virginia University brugte VULCAN ved Spallation Neutron Source til at studere materialer kaldet højentropioxider til at udvikle industrielle og forbrugerbaserede applikationer til f
West Virginia forskere bruger neutroner til at studere materialer til forbedringer af kraftværkerForskere fra West Virginia University brugte VULCAN ved Spallation Neutron Source til at studere materialer kaldet højentropioxider til at udvikle industrielle og forbrugerbaserede applikationer til f -
 Ny beregningsmetode til lægemiddelopdagelseForsidebilledet illustrerer TauRAMD-metoden, som er baseret på Random Acceleration Molecular Dynamics-teknikken og designet til beregning af de relative opholdstider, tau, af lægemiddellignende forbin
Ny beregningsmetode til lægemiddelopdagelseForsidebilledet illustrerer TauRAMD-metoden, som er baseret på Random Acceleration Molecular Dynamics-teknikken og designet til beregning af de relative opholdstider, tau, af lægemiddellignende forbin -
 Med køkkenfryser og plantecellulose, der udvikles en aerogel til terapeutisk brugNæsten så let som luft, disse helt naturlige cellulose aerogeler kan fremstilles bæredygtigt, billigt og med alle naturlige materialer. De er også biointeraktive, så de kan bruges til behandling. Kred
Med køkkenfryser og plantecellulose, der udvikles en aerogel til terapeutisk brugNæsten så let som luft, disse helt naturlige cellulose aerogeler kan fremstilles bæredygtigt, billigt og med alle naturlige materialer. De er også biointeraktive, så de kan bruges til behandling. Kred -
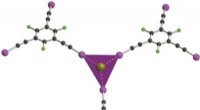 Koordinationskemi af anioner gennem halogenbindingsinteraktionerDetaljen af koordinationssfærerne af bromidanionen med Et3BuN+Br? Kredit:M. Fourmigué Mens en IUPAC-definition af hydrogenbinding først blev frigivet i 2011 efter årtiers diskussioner i det vide
Koordinationskemi af anioner gennem halogenbindingsinteraktionerDetaljen af koordinationssfærerne af bromidanionen med Et3BuN+Br? Kredit:M. Fourmigué Mens en IUPAC-definition af hydrogenbinding først blev frigivet i 2011 efter årtiers diskussioner i det vide
- Hvad er resultatet af hydrolyse af et dipeptid?
- Antarktisk halvø på det varmeste i årtier:undersøgelse
- Sådan laver du en hjemmelavet ozongenerator
- Lipids fysiske og kemiske egenskaber
- Hvis et iltatom delte nogle elektroner med en anden, hvilken type stof ville molekylet være?
- Antarktis, Jordens hjerte har brug for beskyttelse:ekspert


