I modsætning til natrium og klor bliver nogle atomer mere stabile ved at dele?
Her er hvorfor:
* natrium (NA) Har en valenselektron, hvilket betyder, at den ønsker at miste det elektron for at opnå en stabil oktet (8 elektroner i dens ydre skal) som den ædle gas neon.
* klor (Cl) Har syv valenselektroner og ønsker at få et elektron for at opnå en stabil oktet som argon.
Når natrium og klor reagerer, donerer natrium * dets elektron til klor, og danner Na+ og Cl-ioner, som derefter tiltrækker hinanden elektrostatisk. Dette er en ionisk binding .
kovalent binding opstår, når to eller flere atomer deler elektroner for at opnå en stabil oktet. For eksempel:
* brint (H) Har en elektron og har brug for en mere for at opnå en stabil duet (2 elektroner i dens ydre skal). To hydrogenatomer kan dele deres elektroner for at danne en kovalent binding i H2.
* ilt (O) Har seks valenselektroner og har brug for to mere for at opnå en stabil oktet. I O2 deler to iltatomer to par elektroner til dannelse af en dobbelt kovalent binding.
Hvorfor deler nogle atomer, mens andre overfører elektroner?
Den vigtigste faktor, der bestemmer, om et atom vil danne en ionisk eller kovalent binding, er elektronegativitetsforskellen mellem atomerne. Elektronegativitet er et mål for et atoms evne til at tiltrække elektroner.
* stor elektronegativitetsforskel: Hvis elektronegativitetsforskellen mellem to atomer er stor (som natrium og klor), vil det ene atom helt tage elektronet fra det andet og danne en ionisk binding.
* lille elektronegativitetsforskel: Hvis elektronegativitetsforskellen er lille (som brint og ilt), vil atomerne dele elektroner for at opnå stabilitet og danne en kovalent binding.
Kortfattet:
* ioniske bindinger forekommer, når der er en stor elektronegativitetsforskel mellem atomer, hvilket fører til elektronoverførsel.
* kovalente obligationer forekomme, når der er en lille elektronegativitetsforskel mellem atomer, hvilket fører til elektrondeling.
Sidste artikelHvad er atomnummeret på S-2?
Næste artikelLadning af p som en ion?
 Varme artikler
Varme artikler
-
 Ingeniører finder, at flaskebørste -copolymerer kan skræddersys til applikationerRice University kandidatstuderende Hao Mei holder en tallerken med et mønster af flaskebørstepolymerer stavning RICE. De mikroskopiske polymerer kunne give industrien udsøgt kontrol over overfladebelæ
Ingeniører finder, at flaskebørste -copolymerer kan skræddersys til applikationerRice University kandidatstuderende Hao Mei holder en tallerken med et mønster af flaskebørstepolymerer stavning RICE. De mikroskopiske polymerer kunne give industrien udsøgt kontrol over overfladebelæ -
 Livets kilde:Vanddråber rummer den hemmelige ingrediens til at opbygge livKredit:CC0 Public Domain Purdue University kemikere har afsløret en mekanisme til, at peptiddannende reaktioner kan forekomme i vand - noget, der har undret videnskabsmænd i årtier. Dette er i bun
Livets kilde:Vanddråber rummer den hemmelige ingrediens til at opbygge livKredit:CC0 Public Domain Purdue University kemikere har afsløret en mekanisme til, at peptiddannende reaktioner kan forekomme i vand - noget, der har undret videnskabsmænd i årtier. Dette er i bun -
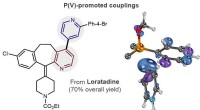 Bevæbning af narkojægere, kemikere designer ny reaktion til lægemiddelopdagelseDet venstre billede er en modifikation af antihistaminlægemidlet loratadin lavet via pyridin-pyridin-koblingsmetoden udviklet af CSU-kemikere. Den fede linje repræsenterer reaktionen, hvis resultat er
Bevæbning af narkojægere, kemikere designer ny reaktion til lægemiddelopdagelseDet venstre billede er en modifikation af antihistaminlægemidlet loratadin lavet via pyridin-pyridin-koblingsmetoden udviklet af CSU-kemikere. Den fede linje repræsenterer reaktionen, hvis resultat er -
 Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o
Nyt lægemiddel kunne forhindre invaliderende bivirkning af kræftbehandlingPladsfyldende struktur skildring af GC4419 baseret på røntgenkrystalstrukturbestemmelse. Kredit:Dennis Riley Omkring 50, 000 mennesker i USA diagnosticeres årligt med hoved, nakke, kræft i næsen o
- Navngiv fem almindelige rock, der danner mineral?
- Største Ichthyosaurus var gravid mor, siger paleontologer
- Opdagelse af fotonik varsler dramatiske effektivitetsgevinster i siliciumchips
- I stand til at blive trukket ind i ledningen?
- Hvor sker ledning på jorden?
- Hvordan COVID muliggjorde nye former for økonomisk misbrug af kvinder i Indien


