Hvordan holdes sølv- og kobberatomerne sammen?
* Hav af elektroner: Ved metallisk binding delokaliseres valenselektroner (yderste elektroner) af metalatomerne, hvilket betyder, at de ikke er bundet til noget bestemt atom. I stedet danner de et "hav" af elektroner, der bevæger sig frit gennem hele metalstrukturen.
* Positive ioner: De delokaliserede elektroner efterlader et gitter af positivt ladede metalioner.
* Elektrostatisk attraktion: Den stærke elektrostatiske attraktion mellem de positive ioner og den negativt ladede elektronhav holder metalatomerne sammen.
nøglefunktioner ved metallisk binding:
* stærk limning: Metalliske bindinger er generelt stærke, hvilket fører til høje smelte- og kogepunkter for metaller.
* duktilitet og formbarhed: De frit bevægende elektroner tillader metalatomer at glide forbi hinanden uden at bryde bindingen, hvilket resulterer i, at metaller let formes (duktilitet) og hamres til tynde lag (formbarhed).
* Konduktivitet: De delokaliserede elektroner kan let bære en elektrisk strøm (elektrisk ledningsevne) og overføre varme (termisk ledningsevne).
* Luster: De frie elektroner i metalstrukturen interagerer med lys, hvilket giver metaller deres karakteristiske glans eller glans.
I tilfælde af sølv og kobber:
* Begge metaller er fremragende ledere af varme og elektricitet.
* De har høje smeltepunkter og er formbare og duktile.
* Deres glans skyldes deres evne til at reflektere lys.
Sidste artikelHvad er formlen med svovl?
Næste artikelHvorfor bliver kaliumatom positivt ladet, og fluor bliver negativt ladet?
 Varme artikler
Varme artikler
-
 Synligt lys og nanopartikelkatalysatorer producerer ønskelige bioaktive molekylerMolekyler adsorberer på overfladen af halvledernanopartikler i meget specifikke geometrier. Nanopartiklerne bruger energi fra indfaldende lys til at aktivere molekylerne og smelte dem sammen til at
Synligt lys og nanopartikelkatalysatorer producerer ønskelige bioaktive molekylerMolekyler adsorberer på overfladen af halvledernanopartikler i meget specifikke geometrier. Nanopartiklerne bruger energi fra indfaldende lys til at aktivere molekylerne og smelte dem sammen til at -
 Røntgenbilleder giver fingerpeg om brud i solid-state batterierMatthew McDowell, en assisterende professor ved George W. Woodruff School of Mechanical Engineering og School of Materials Science and Engineering, undersøger batterier i en cykelstation. Kredit:Rob F
Røntgenbilleder giver fingerpeg om brud i solid-state batterierMatthew McDowell, en assisterende professor ved George W. Woodruff School of Mechanical Engineering og School of Materials Science and Engineering, undersøger batterier i en cykelstation. Kredit:Rob F -
 Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid:
Video:Hvad er kemien bag ringorm?Vidste du, at ringorm faktisk ikke er en orm? Denne uge om reaktioner, find ud af hvad ringorm er; hvordan den skyldige lever af din hud, hår og negle; og hvordan man ikke bliver det næste måltid: -
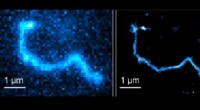 Nye træk for polymerkædedynamikSuperopløsnings fluorescensmikroskopi (højre) giver betydeligt skarpere billeder sammenlignet med konventionel fluorescensmikroskopi. Kredit:Abadi et al. En teknik, der gør det muligt for forskere
Nye træk for polymerkædedynamikSuperopløsnings fluorescensmikroskopi (højre) giver betydeligt skarpere billeder sammenlignet med konventionel fluorescensmikroskopi. Kredit:Abadi et al. En teknik, der gør det muligt for forskere
- Risikoen for tsunamier i Middelhavet er blevet overvurderet
- Batter up (eller ej):Pro baseballspillere med længere kontrakter arbejder ikke altid så hårdt
- Hvad er 4 fysiske egenskaber ved et mineral?
- Hvilken type binding har svovldioxid?
- Kræfter inden for molekyler kan styrke ekstra lange carbon-carbon-bindinger
- Studielånsgælden er stadig en lammende byrde for millioner af amerikanere


