Er molekyler mere aktive i varm luft eller kold luft?
* Temperatur og kinetisk energi: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekyler. Kinetisk energi er bevægelsesenergien.
* Højere temperatur =mere bevægelse: Når luft er varm, har dens molekyler mere kinetisk energi og bevæger sig hurtigere og mere tilfældigt.
* lavere temperatur =mindre bevægelse: I kold luft har molekylerne mindre kinetisk energi og bevæger sig langsommere.
Tænk på det sådan: Forestil dig en gruppe mennesker, der danser. I et varmt rum (varm luft) vil folk danse med mere energi og bevæge sig mere rundt. I et koldt rum (kold luft) vil de være mere træg og bevæge sig mindre.
Denne øgede molekylære aktivitet i varm luft er grunden til:
* Gasser udvides, når de opvarmes: Den øgede bevægelse af molekyler får dem til at sprede sig og optager mere plads.
* reaktioner sker hurtigere ved højere temperaturer: Den øgede kollisionshastighed mellem molekyler på grund af deres højere energi øger sandsynligheden for, at kemiske reaktioner forekommer.
* Fordampning sker hurtigere ved højere temperaturer: Flere energiske molekyler er mere tilbøjelige til at bryde fri fra væskefasen og blive en gas.
Sidste artikelHvilke metaller ruster ikke?
Næste artikelHvor mange nitrogenatomer er til stede i 5,00 g C2H5O2N?
 Varme artikler
Varme artikler
-
 Årsager til beton- og asfaltforringelse forklaretEt nærbillede af en bro, viser forringet asfaltbelægning og beton. Kredit:Akihiro Moriyoshi Forskere har afsløret, at forringelsen af moderne beton- og asfaltstrukturer skyldes tilstedeværelsen
Årsager til beton- og asfaltforringelse forklaretEt nærbillede af en bro, viser forringet asfaltbelægning og beton. Kredit:Akihiro Moriyoshi Forskere har afsløret, at forringelsen af moderne beton- og asfaltstrukturer skyldes tilstedeværelsen -
 Redder gadekunst fra vandalernes graffitiKredit:CC0 Public Domain Fra Los Angeles og Lower East Side af New York City til Paris og Penang, gadekunst af berømte og knap så berømte kunstnere pryder motorveje, veje og stræder. Ud over at sk
Redder gadekunst fra vandalernes graffitiKredit:CC0 Public Domain Fra Los Angeles og Lower East Side af New York City til Paris og Penang, gadekunst af berømte og knap så berømte kunstnere pryder motorveje, veje og stræder. Ud over at sk -
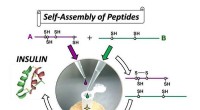 Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in
Højeffektiv syntese af insulin ved selvsamling baseret organisk kemiEn simpel protokol udviklet til insulinpræparation. Kredit:Michio Iwaoka Forskere ved Tokai, Osaka, Tohoku og Fukuoka Universiteter rapporterer i tidsskriftet Kommunikationskemi på syntese af in -
 Ny tekstilfarvningsmetode reducerer drastisk vandbehov og giftig udledning af farvestoffer drastiskAnuradhi Liyanapathiranage er ph.d. kandidat i College of Family and Consumer Sciences. Kredit:Nancy Evelyn/UGA Anuradhi Liyanapathiranage brænder for bæredygtighed og beskyttelse af miljøet genne
Ny tekstilfarvningsmetode reducerer drastisk vandbehov og giftig udledning af farvestoffer drastiskAnuradhi Liyanapathiranage er ph.d. kandidat i College of Family and Consumer Sciences. Kredit:Nancy Evelyn/UGA Anuradhi Liyanapathiranage brænder for bæredygtighed og beskyttelse af miljøet genne


