Et stykke jern, der vejer 85,65 g, blev brændt i luft, den masse, oxidet producerede 118,37 Brug molær til at konvertere brugte mol?
1. Bestem massen af ilt
* Massen af ilt, der reagerede med jernet, er forskellen mellem massen af oxidet og jernmassen:
* Masse ilt =118,37 g - 85,65 g =32,72 g
2. Konverter masser til mol
* jern (Fe):
* Molmasse af Fe =55,845 g/mol
* Mol Fe =(85,65 g) / (55,845 g / mol) =1,534 mol
* ilt (O):
* Molmasse på O =16,00 g/mol
* Mol O =(32,72 g) / (16,00 g / mol) =2,045 mol
3. Bestem den empiriske formel
* Opdel antallet af mol af hvert element med det mindste antal mol for at få det enkleste forhold mellem hele nummer:
* FE:1.534 mol / 1.534 mol =1
* O:2,045 mol / 1,534 mol =1,33
* Da vi har brug for hele tal, skal du multiplicere begge forhold med 3 for at få:
* FE:3
* O:4
4. Den empiriske formel
* Den empiriske formel for jernoxidet er fe₃o₄ .
Bemærk: Dette er formlen for et specifikt jernoxid kaldet magnetit.
 Varme artikler
Varme artikler
-
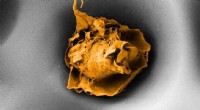 Hvorfor hviler makrofager i sundt vævEn makrofag i en pore, der måler 20 mikrometer på tværs (elektronmikroskopbillede). Kredit:ETH Zürich / Nikhil Jain og Isabel Gerber ETH -forskere har vist, at immunsystemets makrofager ikke kun r
Hvorfor hviler makrofager i sundt vævEn makrofag i en pore, der måler 20 mikrometer på tværs (elektronmikroskopbillede). Kredit:ETH Zürich / Nikhil Jain og Isabel Gerber ETH -forskere har vist, at immunsystemets makrofager ikke kun r -
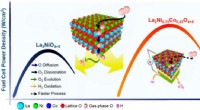 Nyopdagede designregler fører til bedre brændselscellekatalysatorForskere afslørede hemmeligheden bag at designe elektroder med bedre ydeevne (elektrokatalysatorer). Effektdensitetskurverne viser, at den nydesignede katalysator (rød kurve) overgår en lignende katal
Nyopdagede designregler fører til bedre brændselscellekatalysatorForskere afslørede hemmeligheden bag at designe elektroder med bedre ydeevne (elektrokatalysatorer). Effektdensitetskurverne viser, at den nydesignede katalysator (rød kurve) overgår en lignende katal -
 Fødevareforskere skaber nye magnetiske nanopartikler til hurtig screening af pesticidrester i grøn…Figur illustrerer processen involveret i at bruge polystyrencoatede magnetiske nanopartikler (mikromagneter) til at udvinde spor af pesticidrester fra vegetabilske prøver. Kredit:Yu Xi Fødevarefor
Fødevareforskere skaber nye magnetiske nanopartikler til hurtig screening af pesticidrester i grøn…Figur illustrerer processen involveret i at bruge polystyrencoatede magnetiske nanopartikler (mikromagneter) til at udvinde spor af pesticidrester fra vegetabilske prøver. Kredit:Yu Xi Fødevarefor -
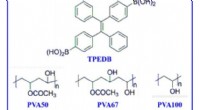 Storskala fremstilling af polymerbaseret stuetemperatur phosphorescens via klikkemiMolekylformler for fosfor og polymermatricer. De molekylære formler for TPEDB, PVA med forskellig alkohollysegrad (PVA50, PVA67, PVA100), og kontrollerede polymerer (PDDA, PSS, og PVDF). Kredit:Scienc
Storskala fremstilling af polymerbaseret stuetemperatur phosphorescens via klikkemiMolekylformler for fosfor og polymermatricer. De molekylære formler for TPEDB, PVA med forskellig alkohollysegrad (PVA50, PVA67, PVA100), og kontrollerede polymerer (PDDA, PSS, og PVDF). Kredit:Scienc
- Hvordan hjalp røntgenbilleder med at afsløre insekters fysiologiske reaktioner på tyngdekraften?
- Kontrolleret og målrettet frigivelse af lægemidler
- Kunstig intelligens guider hurtig datadrevet udforskning af undervandshabitater
- Ændringer i svineavl i det 20. århundrede spredte antibiotika-resistent Salmonella rundt om i verd…
- Nye linser muliggør røntgenmikroskopi med rekordopløsning
- Teknologi gør smartphones til on-the-spot detektorer for fødevarebårne sygdomme, andre farlige fo…


