Kontrolleret og målrettet frigivelse af lægemidler

Kredit:Adolphe Merkle Instituttet - Fribourg Universitet
(Phys.org) —Forskere har opdaget en metode, der muliggør kontrolleret frigivelse af et aktivt middel på basis af et magnetisk nanovehicle. Forskningen, udført af EPFL, Adolphe Merkle Institute og Universitetshospitalet i Genève, åbner nye muligheder for udvikling af mål.
Visse lægemidler er giftige af natur. For eksempel, lægemidler mod kræft, udviklet til at dræbe syge celler, skader også raske. For at begrænse bivirkningerne af kemoterapi, det ville være et stort skridt fremad, hvis det kun var muligt at frigive et lægemiddel i det berørte område af kroppen. I forbindelse med det nationale forskningsprogram "Smart Materials" (NRP 62) - et samarbejde mellem SNSF og Kommissionen for teknologi og innovation (CTI) - forskere fra ETH Lausanne, Adolphe Merkle Instituttet og Universitetshospitalet i Genève har opdaget en metode, der kan repræsentere et vigtigt skridt hen imod udviklingen af et intelligent lægemiddel af denne art. Ved at kombinere deres ekspertviden inden for materialevidenskab, biologiske nanomaterialer og medicin, de var i stand til at bevise gennemførligheden af at bruge et nanovehicle til at transportere narkotika og frigive dem på en kontrolleret måde.
Denne nanokontainer er et liposom, som tager form af en vesikel. Den har en diameter på 100 til 200 nanometer og er 100 gange mindre end en menneskelig celle. Vesiklens membran er sammensat af fosfolipider, og indersiden af vesiklen giver plads til lægemidlet. På overfladen af liposomet, specifikke molekyler hjælper med at målrette ondartede celler og skjule nanobeholderen for immunsystemet, som ellers kunne betragte det som en fremmed enhed og søge at ødelægge det. Nu behøvede forskerne kun at opdage en mekanisme til at åbne membranen efter behag.
Nano effekt
Det er præcis, hvad forskerne lykkedes med. Hvordan gjorde de det? Ved at integrere i liposommembranen superparamagnetiske jernoxidnanopartikler (SPION), som kun bliver magnetiske i nærvær af et eksternt magnetfelt. Når de først er i marken, SPION varmes op. Varmen gør membranen permeabel og stoffet frigives. Forskere beviste gennemførligheden af et sådant nano-fartøj ved at frigive på en kontrolleret måde et farvet stof indeholdt i liposomerne. "Vi kan virkelig tale om nanomedicin i denne sammenhæng, fordi, ved at udnytte superparamagnetisme, vi udnytter en kvanteeffekt, der kun findes på niveau med nanopartikler, " forklarer Heinrich Hofmann fra Powder Technology Laboratory i EPFL. SPION er også et fremragende kontrastmiddel i magnetisk resonansbilleddannelse (MRI). En simpel MR viser placeringen af SPION og giver mulighed for frigivelse af lægemidlet, når det har nået målet. få øje på.
Designet til medicinsk praksis
"For at maksimere chancerne for at opdage en effektiv behandling, vi fokuserede på nanocontainere, som let ville blive accepteret af læger, "tilføjer Heinrich Hofmann. Denne strategi begrænser mulighederne. Liposomer, som allerede anvendes i en række lægemidler på markedet, er sammensat af naturlige fosfolipider, som også findes i membraner i humane celler. For at åbne dem op, forskere fokuseret på SPION, som allerede havde været genstand for talrige toksikologiske undersøgelser. Mere effektive materialer blev ignoreret, fordi lidt eller intet var kendt om deres virkninger på mennesker. Med hensyn til form, en anden vigtig parameter for magnetisme, de valgte kun at bruge sfæriske nanopartikler, der betragtes som sikrere end fibrøse former. Intensiteten og frekvensen af det magnetiske felt, der er nødvendigt for at frigive det aktive middel, er forenelige med menneskelig fysiologi.
Kombinationen af disse parametre stillede forskerne over for en anden udfordring:at nå en temperatur, der er tilstrækkelig høj til at åbne liposomerne, de blev tvunget til at øge størrelsen af SPION fra 6 til 15 nanometer. Blærens membran har en tykkelse på kun 4-5 nanometer. Derefter mesterslaget:Alke Finks forskningsgruppe ved Adolphe Merkle Institute var i stand til at omgruppere SPION i en del af membranen. Dette gjorde også MR-detektion lettere. Inden in-vivo-test påbegyndes, forskerne sigter mod at studere integrationen af SPION i liposommembranen mere detaljeret.
 Varme artikler
Varme artikler
-
 Eksperter i 3D-print opdager, hvordan man laver fremtidens teknologi ved hjælp af inkjet-printet gr…Et repræsentativt arrangement af grafenflager i inkjet-printet grafen mellem to kontakter (grøn). Farvegradient svarer til variation af flagepotentialer. Kredit:University of Nottingham University
Eksperter i 3D-print opdager, hvordan man laver fremtidens teknologi ved hjælp af inkjet-printet gr…Et repræsentativt arrangement af grafenflager i inkjet-printet grafen mellem to kontakter (grøn). Farvegradient svarer til variation af flagepotentialer. Kredit:University of Nottingham University -
 Ny anti-COVID-19 nanocoating overflade udvikletDette scanningselektronmikroskopbillede viser SARS-CoV-2 (gul) - også kendt som 2019-nCoV, den virus, der forårsager COVID-19 – isoleret fra en patient, kommer frem fra overfladen af celler (blå/pin
Ny anti-COVID-19 nanocoating overflade udvikletDette scanningselektronmikroskopbillede viser SARS-CoV-2 (gul) - også kendt som 2019-nCoV, den virus, der forårsager COVID-19 – isoleret fra en patient, kommer frem fra overfladen af celler (blå/pin -
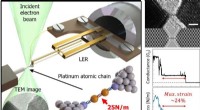 Hængende i en tråd:Billeddannelse og sondering af kæder af enkelte atomerFigur 1. Mikroskopisk nanomekanik målemetode (venstre). Skematisk illustration af teknikken. Stivheden af nanomaterialer såsom platin (Pt) atomkæder kan måles ved hjælp af en længde-forlængelse reso
Hængende i en tråd:Billeddannelse og sondering af kæder af enkelte atomerFigur 1. Mikroskopisk nanomekanik målemetode (venstre). Skematisk illustration af teknikken. Stivheden af nanomaterialer såsom platin (Pt) atomkæder kan måles ved hjælp af en længde-forlængelse reso -
 Konstruerede materialer:Specialfremstillede magneterEn række metamolekyler bestående af siliciumkugler og kobbersplitringe kan bruges til at kontrollere magnetiseringsbølger. Kredit:2012 American Chemical Society En ny tilgang til at designe kunsti
Konstruerede materialer:Specialfremstillede magneterEn række metamolekyler bestående af siliciumkugler og kobbersplitringe kan bruges til at kontrollere magnetiseringsbølger. Kredit:2012 American Chemical Society En ny tilgang til at designe kunsti
- Sådan hjælper du NASA med at indsamle data under den kommende solformørkelse
- Amazonas skovrydning og antallet af brande viser, at sommeren 2019 ikke er et normalt år
- Undersøgelse:Folk kan bruge overmod til at overtale eller bedrage andre
- Med rensere og retssager, Pakistanere kæmper tilbage mod smog
- The Very Large Array:Astronomisk shapeshifter
- Forskere foreslår nye højtydende dual-ion-batterier med 3-D porøs struktur


