Hvad er hydroxidionkoncentrationen i en vandig opløsning, som hydronium 0,13M?
forståelse af forholdet
* kW (ionproduktkonstant af vand): Produktet af hydroniumionkoncentrationen ([H3O+]) og hydroxidionkoncentrationen ([OH-]) i vand er altid en konstant ved en given temperatur. Denne konstant kaldes KW og har en værdi på 1,0 x 10^-14 ved 25 ° C.
* Ligning: Kw =[h3o+] [oh-]
Beregning
1. Start med den givne hydroniumionkoncentration: [H3O+] =0,13 m
2. Brug KW -ligningen til at løse for hydroxidionkoncentrationen:
* 1,0 x 10^-14 =(0,13 m) * [OH-]
* [Oh-] =(1,0 x 10^-14) / (0,13 m)
* [OH-] ≈ 7,7 x 10^-14 m
Svar: Hydroxidionkoncentrationen i opløsningen er ca. 7,7 x 10^-14 M.
Sidste artikelHvad er hårdhedsværdien for kulstof?
Næste artikelHvilken del af fjedermodellerne Hvordan molekyler luft er tæt sammen?
 Varme artikler
Varme artikler
-
 Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var
Flyveaske geopolymerbeton:Betydeligt forbedret modstandsdygtighed over for ekstremt alkaliangrebGeopolymer betonblokke, varmehærdet ved 200 grader Celsius og derefter nedsænket i et ekstremt alkalisk medium i 14 dage ved 80 grader Celsius (a og b), modstå angrebet væsentligt bedre end blokke var -
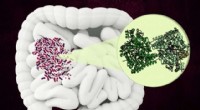 Bakterielt enzym kan blive et nyt mål for antibiotikaMIT-forskere har opdaget strukturen af et usædvanligt enzym, som nogle mikrober bruger til at nedbryde en komponent af kollagen i den menneskelige tarm. Kredit:Christine Daniloff, MIT MIT og Har
Bakterielt enzym kan blive et nyt mål for antibiotikaMIT-forskere har opdaget strukturen af et usædvanligt enzym, som nogle mikrober bruger til at nedbryde en komponent af kollagen i den menneskelige tarm. Kredit:Christine Daniloff, MIT MIT og Har -
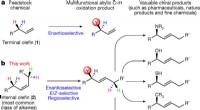 Forskere rapporterer om kemisk reaktion med potentiale til at fremskynde lægemiddeludviklingKatalytisk enantioselektiv oxidation af uaktiverede terminale og interne alkener. Kredit: Natur (2017). DOI:10.1038/nature22805 Kemikere har længe søgt at udvikle nye reaktioner til direkte omdan
Forskere rapporterer om kemisk reaktion med potentiale til at fremskynde lægemiddeludviklingKatalytisk enantioselektiv oxidation af uaktiverede terminale og interne alkener. Kredit: Natur (2017). DOI:10.1038/nature22805 Kemikere har længe søgt at udvikle nye reaktioner til direkte omdan -
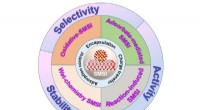 Nye ruter til konstruktion af stærke metal-støtte-interaktionerForskellige nye ruter til konstruktion af SMSIer blev afsluttet, hvor aktiviteten, selektiviteten og stabiliteten af de understøttede metalkatalysatorer modificeres, hvilket giver en effektiv måde a
Nye ruter til konstruktion af stærke metal-støtte-interaktionerForskellige nye ruter til konstruktion af SMSIer blev afsluttet, hvor aktiviteten, selektiviteten og stabiliteten af de understøttede metalkatalysatorer modificeres, hvilket giver en effektiv måde a


