Når klor får en elektron, hvilken slags ion er det?
Her er hvorfor:
* Chlorens atomstruktur: Klor har 17 elektroner. Dens yderste skal (valensskallen) har 7 elektroner.
* octet regel: Atomer har en tendens til at vinde, miste eller dele elektroner for at opnå en stabil konfiguration af 8 elektroner i deres yderste skal.
* At få en elektron: For at opnå en fuld oktet får klor en elektron. Dette giver det i alt 18 elektroner med 8 i sin yderste skal.
* negativ opladning: Ved at få en elektron får klor en negativ ladning, da elektroner har en negativ ladning.
Derfor får klor et elektron til dannelse af en chloridion (CL-) med en enkelt negativ ladning.
Sidste artikelHvordan er atomiske og molekylære orbitaler relateret?
Næste artikelFaste partikler i atmosfæren inkluderer salt og?
 Varme artikler
Varme artikler
-
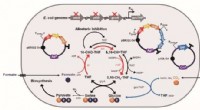 Konstrueret E. coli ved hjælp af myresyre og CO2 som en C1-raffinaderiplatformstammeMyresyre- og CO2-assimileringsveje bestående af den rekonstruerede THF-cyklus og omvendt glycin-spaltningsreaktion. Dette skematiske diagram viser myresyre- og CO2-assimileringsproceduren gennem vejen
Konstrueret E. coli ved hjælp af myresyre og CO2 som en C1-raffinaderiplatformstammeMyresyre- og CO2-assimileringsveje bestående af den rekonstruerede THF-cyklus og omvendt glycin-spaltningsreaktion. Dette skematiske diagram viser myresyre- og CO2-assimileringsproceduren gennem vejen -
 Genanvendelse af sjældne jordarters magneter er en kværn, men ny proces tager en enklere tilgangPlasma lommelygte afsætter genbrugsmagnetmateriale. Kredit:Ames Laboratory En ny genbrugsproces udviklet ved det amerikanske energiministeriums Critical Materials Institute (CMI) forvandler kasser
Genanvendelse af sjældne jordarters magneter er en kværn, men ny proces tager en enklere tilgangPlasma lommelygte afsætter genbrugsmagnetmateriale. Kredit:Ames Laboratory En ny genbrugsproces udviklet ved det amerikanske energiministeriums Critical Materials Institute (CMI) forvandler kasser -
 Simpel kemi vil øge bæredygtigheden af betonproduktionKredit:University of Tokyo Forskere ved Institut for Industrividenskab, en del af University of Tokyo, har udviklet en ny metode til fremstilling af beton uden cement. De har direkte bundet sandpa
Simpel kemi vil øge bæredygtigheden af betonproduktionKredit:University of Tokyo Forskere ved Institut for Industrividenskab, en del af University of Tokyo, har udviklet en ny metode til fremstilling af beton uden cement. De har direkte bundet sandpa -
 Små enzym-lignende polymerer kan have hjulpet med at starte livetMikrofotografiet viser ensartede nanopartikler under 10 nm i diameter. Kredit:Tony Z. Jia, ELSI Den største indsats inden for forskning i livets oprindelse er fokuseret på at forstå den præbiotisk
Små enzym-lignende polymerer kan have hjulpet med at starte livetMikrofotografiet viser ensartede nanopartikler under 10 nm i diameter. Kredit:Tony Z. Jia, ELSI Den største indsats inden for forskning i livets oprindelse er fokuseret på at forstå den præbiotisk
- Hvad får du, når du tilføjer natriumsulfid til tinchlorid?
- Sådan fungerer kloning
- Hvorfor fortsætter du med at bruge fossile brændstoffer i stedet for vedvarende ressourcer?
- Hvorfor ser månen nogle gange orange ud?
- Hvordan påvirker din hjerne dine overlevelseschancer i ørkenen?
- Dyrehul, der er gravet i sten, der lader vand og luftkemisk eller mekanisk?


