Hvordan er atomiske og molekylære orbitaler relateret?
atomiske orbitaler:
* Definition: Atomiske orbitaler repræsenterer områderne rum omkring en atoms kerne, hvor der er stor sandsynlighed for at finde en elektron.
* Typer: De er kendetegnet ved deres form (S, P, D, F) og energiniveau.
* fokus: Atomiske orbitaler beskriver opførsel af elektroner inden for et enkelt atom.
molekylære orbitaler:
* Definition: Molekylære orbitaler repræsenterer områderne rum omkring kernerne i flere atomer i et molekyle, hvor der er stor sandsynlighed for at finde en elektron.
* dannelse: Molekylære orbitaler stammer fra overlapningen af atomiske orbitaler fra forskellige atomer, når de binder. Denne overlapning kan være konstruktiv (binding) eller destruktiv (antibonding).
* fokus: Molekylære orbitaler beskriver opførslen af elektroner i hele molekylet, der omfatter interaktioner mellem atomer.
Forholdet:
1. overlapning og kombination: Når atomer nærmer sig hinanden for at danne en binding, interagerer og overlapper deres atomiske orbitaler. Denne overlapning fører til dannelse af molekylære orbitaler.
2. Konstruktiv og destruktiv interferens: Den måde atomiske orbitaler overlapper hinanden bestemmer typen af dannet molekylær orbital.
* Konstruktiv interferens: Fører til binding af molekylære orbitaler, der har lavere energi end de originale atomiske orbitaler og bidrager til molekylets stabilitet.
* destruktiv interferens: Fører til antibonding molekylære orbitaler, der har højere energi end de originale atomiske orbitaler og destabilisere molekylet.
3. Bestilling af energiniveau: Molekylære orbitaler er arrangeret i stigende energiniveauer, der ligner atomiske orbitaler. Elektroner udfylder disse orbitaler efter Aufbau -princippet og Hunds regel.
Eksempel:
* H2 -molekyle: De to hydrogenatomer har hver en 1S -atomisk orbital. Disse orbitaler overlapper hinanden for at danne en Sigma -bindingsmolekylær orbital (σ) og en Sigma -antibonding molekylær orbital (σ*). De to elektroner i H2-molekylet optager den lavere energi Sigma-binding Orbital, hvilket bidrager til molekylets stabilitet.
I det væsentlige er atomiske orbitaler byggestenene til molekylære orbitaler. Den måde, disse atomiske orbitaler kombinerer, bestemmer egenskaberne for de resulterende molekylære orbitaler, som igen påvirker molekylets samlede opførsel og stabilitet.
Sidste artikelHvad produceres, når syre reagerer med vand?
Næste artikelNår klor får en elektron, hvilken slags ion er det?
 Varme artikler
Varme artikler
-
 Computermodeller tilføjer syden til kultiverede kødalternativerLaboratoriedyrket kød skal være mere økonomisk, hvis det kan hjælpe kødproducenterne med at imødekomme efterspørgslen, ifølge forskere. Kredit:CC0 Public Domain Eksperter forudsiger, at produktion
Computermodeller tilføjer syden til kultiverede kødalternativerLaboratoriedyrket kød skal være mere økonomisk, hvis det kan hjælpe kødproducenterne med at imødekomme efterspørgslen, ifølge forskere. Kredit:CC0 Public Domain Eksperter forudsiger, at produktion -
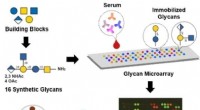 Forskere identificerer potentielle vaccinemål, der i stigende grad vedrører bakteriestammeGrafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202209556 Acinetobacter baumannii er et bakterielt patogen, der er ansvarlig for alvorlige hospitalsrelater
Forskere identificerer potentielle vaccinemål, der i stigende grad vedrører bakteriestammeGrafisk abstrakt. Kredit:Angewandte Chemie International Edition (2022). DOI:10.1002/anie.202209556 Acinetobacter baumannii er et bakterielt patogen, der er ansvarlig for alvorlige hospitalsrelater -
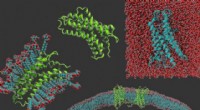 Forskere ændrer membranproteiner for at gøre dem nemmere at studereMed uret fra venstre:en g-proteinkoblet receptor i vaskemiddel, proteinet alene, en g-protein koblet receptor, der er blevet gjort vandopløselig, og g-proteinkoblede receptorer indlejret i en membran.
Forskere ændrer membranproteiner for at gøre dem nemmere at studereMed uret fra venstre:en g-proteinkoblet receptor i vaskemiddel, proteinet alene, en g-protein koblet receptor, der er blevet gjort vandopløselig, og g-proteinkoblede receptorer indlejret i en membran. -
 Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
Molekylær magnetisme pakker strøm med messenger -elektronAtomer på tilstødende molekyler som dette kan kobles til en lang, magnetisk kæde, skabe en ny type magnetisk struktur, siger John Berry, professor i kemi ved University of Wisconsin-Madison. Kredit:Da
- Hvad er et gasformigt produkt af fotosyntesen?
- Volumenet af en gas er op, så hvad presset?
- Hvilken pasentage af jorden er vand?
- Kønskvotering i erhvervslivet – hvordan har europæerne det?
- Følelsesgenkendelse baseret på paralingvistisk information
- Hvad sker der, når en ladet genstand bringes i nærheden af metallisk, der ikke er opladet?


