Hvorfor benzoesyreopløselig i ethylacetat?
1. Lignende polaritet: Både benzoinsyre og ethylacetat er polar Molekyler. Benzoesyre har en polær carboxylgruppe (-COOH), og ethylacetat har en polær estergruppe (-coo-). Denne lighed i polaritet giver dem mulighed for at interagere gennem dipol-dipol-kræfter , som bidrager til opløselighed.
2. Hydrogenbinding: Mens svagere end carboxylgruppen i benzoesyre, kan estergruppen i ethylacetat stadig deltage i hydrogenbinding med carboxylgruppen af benzoesyre. Denne interaktion forbedrer yderligere opløselighed.
3. Ikke-polære interaktioner: ikke-polær phenylring af benzoesyre kan interagere med alkylgruppen af ethylacetat gennem van der Waals Forces . Disse interaktioner bidrager også til opløselighed.
Kortfattet: Kombinationen af polære interaktioner , hydrogenbinding og ikke-polære interaktioner Mellem benzoesyre og ethylacetat resulterer i en betydelig grad af opløselighed.
Det er dog vigtigt at bemærke, at benzoesyre er ikke helt opløselig I ethylacetat. Opløseligheden er påvirket af faktorer som temperatur, koncentration og tilstedeværelsen af andre opløste stoffer.
Sidste artikelHvilket mineral har en hårdhed på 2?
Næste artikelHvad er natrium flygtigt?
 Varme artikler
Varme artikler
-
 Svejsning med stamceller til næste generations kirurgiske limKredit:CC0 Public Domain Forskere ved University of Bristol har opfundet en ny teknologi, der kan føre til udviklingen af en ny generation af smarte kirurgiske lim og forbindinger til kroniske s
Svejsning med stamceller til næste generations kirurgiske limKredit:CC0 Public Domain Forskere ved University of Bristol har opfundet en ny teknologi, der kan føre til udviklingen af en ny generation af smarte kirurgiske lim og forbindinger til kroniske s -
 Forskere opdager ny struktur for lovende materialeklasserBiwu Ma, professor i kemi og biokemi, offentliggjort en ny undersøgelse om, hvordan en ny struktur kunne skabe blåt lys i en type materiale kaldet en perovskit. Kredit:Florida State University Flo
Forskere opdager ny struktur for lovende materialeklasserBiwu Ma, professor i kemi og biokemi, offentliggjort en ny undersøgelse om, hvordan en ny struktur kunne skabe blåt lys i en type materiale kaldet en perovskit. Kredit:Florida State University Flo -
 Undersøgelse kan hjælpe med at booste peptiddesignKredit:CC0 Public Domain Peptider, som er korte rækker af aminosyrer, spiller en afgørende rolle i sundhed og industri med en lang række medicinske anvendelser, herunder i antibiotika, anti-inflam
Undersøgelse kan hjælpe med at booste peptiddesignKredit:CC0 Public Domain Peptider, som er korte rækker af aminosyrer, spiller en afgørende rolle i sundhed og industri med en lang række medicinske anvendelser, herunder i antibiotika, anti-inflam -
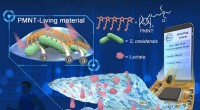 Fleksibel bioelektronisk enhed baseret på levende materiale til overvågning af laktat- og tumorcel…Skematisk diagram af PMNT-baseret levende materiale og bioelektronisk enhed til overvågning af laktat i fysiologiske væsker (sved, urin og plasma) og tælling af tumorceller. Kredit:Wang Zenghao Eft
Fleksibel bioelektronisk enhed baseret på levende materiale til overvågning af laktat- og tumorcel…Skematisk diagram af PMNT-baseret levende materiale og bioelektronisk enhed til overvågning af laktat i fysiologiske væsker (sved, urin og plasma) og tælling af tumorceller. Kredit:Wang Zenghao Eft
- Nævn den tilstandsændring, der sker, når osmium opvarmes fra 4000© til 6000©?
- Pigge af grafen kan dræbe bakterier på implantater
- Sådan konverteres centimeter til Meters
- I produktdesign, at forestille sig slutbrugeres følelser fører til mere originale resultater
- Clingy kobberioner bidrager til katalysatorafmatning
- 54 ounces svarer til hvor mange pund?


