Undersøgelse kan hjælpe med at booste peptiddesign
Kredit:CC0 Public Domain
Peptider, som er korte rækker af aminosyrer, spiller en afgørende rolle i sundhed og industri med en lang række medicinske anvendelser, herunder i antibiotika, anti-inflammatoriske og anti-cancer lægemidler. De bruges også i kosmetikindustrien og til at forbedre atletisk præstation. Ændring af strukturen af naturlige peptider for at producere forbedrede forbindelser er derfor af stor interesse for videnskabsmænd og industri. Men hvordan maskineriet, der producerer disse peptider, fungerer, er stadig ikke klart forstået.
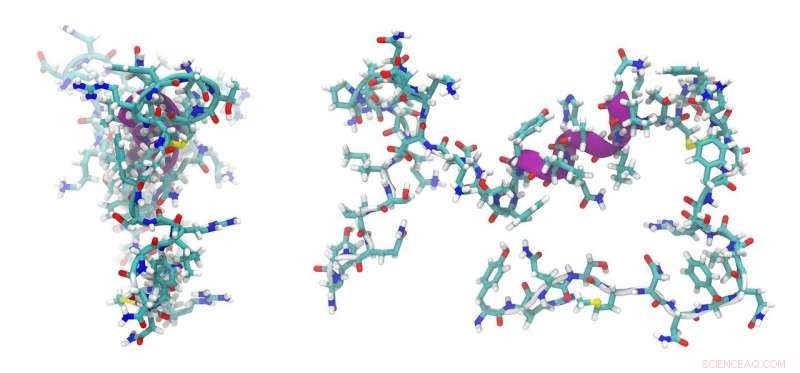
Lektor Max Cryle fra Monash University's Biomedicine Discovery Institute (BDI) har afsløret et nøgleaspekt af peptidmaskineri i et papir offentliggjort i Naturkommunikation i dag, der giver en nøgle til den hellige gral af re-engineering af peptider.
Resultaterne vil fremme hans laboratoriums arbejde med at omstrukturere glycopeptidantibiotika for at imødegå den presserende globale trussel fra antimikrobiel resistens, og mere bredt til at forbedre egenskaberne af peptider generelt.
"Peptidsyntesemaskiner er ofte stort set modulære samlebånd, hvor hvert modul består af forskellige komponentdele. Ændre, hvad du laver i disse samlebånd, det er, peptider med nye bioaktiviteter, er en 'hellig gral' i redesign, " Lektor Cryle sagde. "En af de ting, vi forsøgte at forstå i denne undersøgelse var, hvor selektiviteten af disse maskiner kommer fra - de er meget selektive til at lave et specifikt peptid, og det er lidt af en forståelse af, hvor denne specificitet kommer fra. mysterium, " han sagde.
"Vi var i stand til strukturelt at karakterisere en del af et sådant maskineri, der genererer forbindelserne i peptiderne på et stadium, der ikke tidligere er blevet bestemt. Det, vi viste, er, at disse domæner, der er ansvarlige for koblingen af aminosyrer til peptider, ikke gør det. spille en generel rolle i udvælgelsen af aminosyrerne under denne proces."
"Dette er gode nyheder fra et re-engineeringssynspunkt, fordi det betyder, at vi ikke behøver at bekymre os om at ændre flere dele af maskineriet for at foretage enkelte aminosyreændringer, vi skal bare fokusere på at ændre byggestenen, der går ind, og det er ret lovende."
Lektor Cryle ledede et tværfagligt team af videnskabsmænd, som fik en række forskellige teknikker til at modellere peptidstrukturerne, herunder at bruge den australske synkrotron til røntgenkrystallografi sammen med kemiske og biokemiske teknikker. Han samarbejdede med grupper i Canberra, Brisbane og Tyskland, der hjalp med beregningsmodellering og bioinformatik.
"Vores evne til at forstå de enzymer, der laver naturlige peptider, er nøglen til vores evne til at producere forbedrede til at målrette problemer som antimikrobiel resistens, " sagde han. "Nu kan vi faktisk begynde at tænke på måder at ændre maskineriets accept af forskellige byggesten og på denne måde kan vi lave nye peptider med forbedrede antibakterielle egenskaber, " han sagde.
I fremtiden, et samarbejde med Dr. Evi Stegmanns gruppe ved universitetet i Tübingen i Tyskland vil hjælpe med at omsætte resultaterne fra en teoretisk laboratorieløsning til på sigt at udvikle en kommerciel produktion af nye og forbedrede antibiotika, han sagde.
 Varme artikler
Varme artikler
-
 Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort
Dens elementære:Ultra-spordetektor tester guldrenhedKhadouja Harouaka (siddende) og Isaac Arnquist forbereder prøver i et ultrarent laboratorium, hvilket er nødvendigt for at sikre nøjagtige massespektrometrimålinger. Kredit:Andrea Starr | Pacific Nort -
 Video:Kemikalierne, vi efterladerKredit:The American Chemical Society Alt, hvad vi bruger, er lavet af kemikalier. Så det er ikke overraskende, at vi opfanger en masse fremmede molekyler fra det, vi støder ind i hele tiden, fra v
Video:Kemikalierne, vi efterladerKredit:The American Chemical Society Alt, hvad vi bruger, er lavet af kemikalier. Så det er ikke overraskende, at vi opfanger en masse fremmede molekyler fra det, vi støder ind i hele tiden, fra v -
 Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer
Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer -
 En katalytisk balancegang for opdeling af vand i hydrogen og iltArgonne -forskere og deres samarbejdspartnere har brugt en ny og kontraintuitiv tilgang til at afbalancere tre vigtige faktorer - aktivitet, stabilitet og ledningsevne - i en ny katalysator designet t
En katalytisk balancegang for opdeling af vand i hydrogen og iltArgonne -forskere og deres samarbejdspartnere har brugt en ny og kontraintuitiv tilgang til at afbalancere tre vigtige faktorer - aktivitet, stabilitet og ledningsevne - i en ny katalysator designet t
- Vandforbrug til træer beregnes for at designe præcisionsvandingssystemer
- Offentligheden tror på, at mere end halvdelen af falske nyheder om sundhedspleje spredes online, …
- Elitekvinder kan have regeret El Argar 4, 000 år siden
- Engagerede CO2-udledninger bringer internationale klimamål i fare, undersøgelse finder
- Undersøgelse af Uranus tyder på, at nogle af dens måner er på kollisionskurs
- Flydende vand er begravet under Mars landskab, siger undersøgelse


