Forskere udvikler en bedre måde at blokere vira, der forårsager luftvejsinfektioner i barndommen
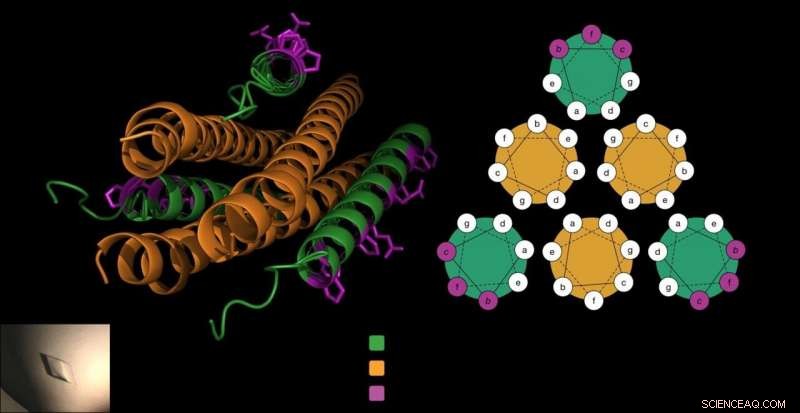
Det antivirale peptid består af tre proptrækkere (i grønt), som låser sig omkring virussens fusionsprotein (i orange) for at forhindre virussen i at trænge ind i cellerne. Gellman-laboratoriet tilføjede unikke beta-aminosyrer til peptidet (i lilla) på en måde, der ikke forstyrrede denne afgørende interaktion og gjorde peptidet mere stabilt. Kredit:Victor Outlaw.
Ved at konstruere et kort stykke protein, eller peptid, som kan forhindre tilknytning af humane parainfluenzavirus til celler, forskere har forbedret en metode i gnavermodeller, der skal hjælpe med at holde børn sunde.
Humane parainfluenzavirus, eller HPIV, er den førende årsag til luftvejsinfektioner i barndommen, ansvarlig for 30% til 40% af sygdomme som kryds og lungebetændelse. Vira påvirker også ældre og mennesker med nedsat immunforsvar.
At syge mennesker, HPIV'er skal låse sig fast på celler og injicere deres genetiske materiale for at begynde at lave nye vira. HPIV3 er den mest udbredte blandt disse vira. Der er i øjeblikket ingen godkendte vacciner eller antivirale midler til HPIV3-infektion hos mennesker.
I en undersøgelse ledet af Sam Gellman-laboratoriet i kemiafdelingen ved University of Wisconsin-Madison, og laboratoriet for Anne Moscona og Matteo Porotto ved Columbia University, forskere byggede på mange års arbejde med peptidbehandlinger for at generere en, der er i stand til at blokere HPIV3-tilknytningsprocessen.
Forskerne offentliggjorde deres resultater 7. april i Journal of the American Chemical Society .
For at indtaste værtsceller, HPIV'er bruger specialiserede fusionsproteiner, der ligner tre proptrækkere lagt side om side. Tidligere arbejde fra Moscona-Porotto-laboratoriet viste, at videnskabsmænd kunne en del af dette proptrækkerprotein fra HPIV3, introducere dette peptid til virussen, og forhindre proptrækkeren i at drive infektionsprocessen. peptidet, selv en proptrækker, lynes i det væsentlige op med virussens proptrækkere, skabe et stramt bundt af seks proptrækkerformer.
Det nye peptid forbliver længere i kroppen, hvilket gør det omkring tre gange mere effektivt til at blokere infektion i gnavere sygdomsmodeller end den oprindelige form.
Forskerholdet startede med at forsøge at konstruere det originale peptid til at være mere modstandsdygtigt over for proteinfordøjende enzymer i kroppen, som nemt kan rive proteiner ned og gøre dem ubrugelige. Så, Gellman-laboratoriet vendte sig til usædvanlige byggesten for at skabe et hårdere peptid.
Celler bygger proteiner ud af alfa-aminosyrer. Men kemikere kan skabe beta-aminosyrer, som ligner hinanden, men har et ekstra carbonatom. Når peptider bruger disse beta-aminosyrebyggesten, de tager ofte en anden form på grund af det ekstra atom. Dette kan hjælpe et peptid med at skjule sig fra protein-fordøjende enzymer og overleve længere.
Imidlertid, forskerne vidste også, at hvis peptidets form ændrede sig for meget som følge af disse usædvanlige byggesten, de låser muligvis ikke sammen med HPIV's proptrækker-fusionsprotein.
Det var her Gellman-laboratoriets årtiers erfaring med at teste og modificere beta-aminosyreholdige peptider blev kritisk.
"Vi ved, hvilken side af peptidet der binder til dets proteinmål. Så, vi (vidste, at vi) kun kan modificere rester, der ikke er direkte involveret i bindingen af det virale protein, " siger Victor Outlaw, en postdoc-forsker i laboratoriet og en af rapportens medførsteforfattere. I laboratorietests, de så, at det omhyggeligt modificerede peptid stadig bandt stærkt til virusets protein.
I en anden forbedring, som var banebrydende af Moscona-Porotto-laboratoriet, forskerne koblede peptidet til et molekyle af kolesterol. Denne fedtholdige tilsætning hjælper peptidet med at glide ind i den fedtede cellemembran, hvor den bedst kan blokere virussen.
"Vores hypotese var, at kombinationen af beta-aminosyrer og kolesterol ville øge anti-viral effekt, " siger Outlaw, som forklarede, at kolesterolet hjalp med at få peptidet derhen, hvor det skulle hen, mens formændringen fra beta-aminosyrerne tillod peptidet at vare længere i kroppen.
Som forskerholdet håbede, da de gav det nye peptid til bomuldsrotter, holdt det meget længere i lungerne end den tidligere version gjorde takket være dets modstandsdygtighed over for fordøjelse fra enzymer. Peptidet blev leveret ind i rotternes næser.
For at teste, hvor godt peptidet virkede for at forhindre infektion, bomuldsrotter modtog det nye peptid, før de blev udsat for HPIV3. Sammenlignet med dyr, der ikke fik antivirale peptider, dem, der fik det forbedrede peptid, havde 10 gange færre vira i deres lunger.
Og sammenlignet med peptidet, der var mere modtageligt for enzymer, det hårdere peptid reducerede virusmængden med omkring tre gange, tyder på, at det nye peptids evne til at undgå fordøjelse i kroppen hjælper det bedre med at blokere infektion.
Selvom tilgangen endnu ikke er blevet testet på mennesker, og forskere skal yderligere forfine og teste systemet, det giver en ny strategi til potentielt at forebygge eller behandle disse almindelige infektioner.
Forskningssamarbejdet søger nu at lave anden generations peptider, der holder endnu længere i kroppen. De ønsker også at teste, hvor godt det modificerede peptid kan blokere infektion med relaterede vira. Denne yderligere forskning kunne flytte peptidbehandlingen tættere på kliniske forsøg.
"Dette var et meget heldigt at komme sammen af grupper, der havde komplementære behov og kapaciteter, " siger Gellman. "Det har virkelig været en stor fælles indsats."
Sidste artikelForskere finder en måde at gøre pultrudering hurtigere
Næste artikelUndersøgelse kan hjælpe med at booste peptiddesign
 Varme artikler
Varme artikler
-
 Lys fra en eksotisk krystalhalvleder kan føre til bedre solcellerKonceptuelt billede af en transistorenhed, der styrer fotoluminescens (den lyserøde kegle), der udsendes af en hybrid perovskitkrystal (den røde boks), der exciteres af en blå laserstråle, efter at sp
Lys fra en eksotisk krystalhalvleder kan føre til bedre solcellerKonceptuelt billede af en transistorenhed, der styrer fotoluminescens (den lyserøde kegle), der udsendes af en hybrid perovskitkrystal (den røde boks), der exciteres af en blå laserstråle, efter at sp -
 "How to Calculate Kb From Ka, 3, [[ Definitionen af en syre og en base i Bronsted Lowry er, at en syre donerer brintioner, mens en base modtager hydrogenioner. Kb er basedissociationskonstanten, eller den måde, hvorpå ion
"How to Calculate Kb From Ka, 3, [[ Definitionen af en syre og en base i Bronsted Lowry er, at en syre donerer brintioner, mens en base modtager hydrogenioner. Kb er basedissociationskonstanten, eller den måde, hvorpå ion -
 Kemikere gør historisk fluorfundKredit:University of Texas i San Antonio En banebrydende opdagelse af kemikere ved University of Texas i San Antonio (UTSA) vil have en betydelig indvirkning på, hvordan medicinalvirksomheder udvi
Kemikere gør historisk fluorfundKredit:University of Texas i San Antonio En banebrydende opdagelse af kemikere ved University of Texas i San Antonio (UTSA) vil have en betydelig indvirkning på, hvordan medicinalvirksomheder udvi -
 Ny maskinlæringsteknik analyserer hurtigt nanomedicin til kræftimmunterapiSNAer er kuglelignende former for DNA og RNA arrangeret på overfladen af en nanopartikel. Kredit:Chad Mirkin/Northwestern University Sfæriske nukleinsyrer er en klasse af personlig medicin til
Ny maskinlæringsteknik analyserer hurtigt nanomedicin til kræftimmunterapiSNAer er kuglelignende former for DNA og RNA arrangeret på overfladen af en nanopartikel. Kredit:Chad Mirkin/Northwestern University Sfæriske nukleinsyrer er en klasse af personlig medicin til
- Luftforureningsniveauer kan påvirke hedebølgerne
- Forsker finder ud af, at amerikanske trådløse netværk hæmmer videostreaming 24/7
- Heritage potential map har til formål at hjælpe byplanlæggere med at bevare historien
- Første søforsøg med en revolutionerende ny undersøisk robot
- Udforskning af nanotrådes indre hemmeligheder
- Kunstige antimikrobielle peptider kan hjælpe med at overvinde lægemiddelresistente bakterier


