Hvor mange mol ammoniakgas findes i en 202 ml beholder ved 35C og 750 mmHg?
1. Konverter enheder
* bind: 202 ml =0,202 L (1 l =1000 ml)
* Temperatur: 35 ° C =308 K (k =° C + 273,15)
* tryk: 750 mmHg =0,987 atm (1 atm =760 mmHg)
2. Brug den ideelle gaslov
Den ideelle gaslov er:PV =NRT
* p: Tryk (i ATM)
* v: Volumen (i L)
* n: Antal mol
* r: Ideel gaskonstant (0,0821 L · ATM/Mol · K)
* t: Temperatur (i k)
3. Løs for N (mol)
Omarranger den ideelle gaslov, der skal løses for N:
n =pv / rt
4. Tilslut værdierne
n =(0,987 atm) (0,202 l) / (0,0821 l · atm / mol · k) (308 K)
5. Beregn
n ≈ 0,0078 mol
Derfor er der ca. 0,0078 mol ammoniakgas i beholderen.
 Varme artikler
Varme artikler
-
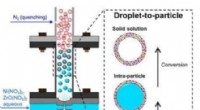 Nanoshell-katalysatorer gør drivhusgasser til nyttige kemikalierEt diagram, der viser, hvordan den nye nikkelbaserede katalysator er skabt ved hjælp af den unikke flammeaerosolproces, der er skabt i Mark Swiharts laboratorium. Kredit:University at Buffalo Et bi
Nanoshell-katalysatorer gør drivhusgasser til nyttige kemikalierEt diagram, der viser, hvordan den nye nikkelbaserede katalysator er skabt ved hjælp af den unikke flammeaerosolproces, der er skabt i Mark Swiharts laboratorium. Kredit:University at Buffalo Et bi -
 Plastik, der redder planeten? Nystartet harpiks hjælper industrien med at blive grønEcoPackers medstiftere og U of T alumnae Kritika Tyagi, Chang Dong og Nuha Siddiqui. Kredit:EcoPackers Nuha Siddiqui gennemsøgte en rapport fra World Economic Forum om plastindustriens fremtid, da
Plastik, der redder planeten? Nystartet harpiks hjælper industrien med at blive grønEcoPackers medstiftere og U of T alumnae Kritika Tyagi, Chang Dong og Nuha Siddiqui. Kredit:EcoPackers Nuha Siddiqui gennemsøgte en rapport fra World Economic Forum om plastindustriens fremtid, da -
 Hvad hvis flyvemaskiner kunne reparere deres egen skade?Kredit:Pixabay. Flyvemaskiner er himmelstrøg; et kommercielt passagerfly er over 6, 000 gange så tung som en stor canadisk gås. Ved 500 mph, imidlertid, disse besætninger er ikke uigennemtrængelig
Hvad hvis flyvemaskiner kunne reparere deres egen skade?Kredit:Pixabay. Flyvemaskiner er himmelstrøg; et kommercielt passagerfly er over 6, 000 gange så tung som en stor canadisk gås. Ved 500 mph, imidlertid, disse besætninger er ikke uigennemtrængelig -
 3-D-billeder af stofsandwich kan hjælpe med at måle tekstilfriktionEt vævet stofoverfladeanalysebillede taget fra Xradia 510 Versa 3D XRM-CT placeret på NC State Analytical Instrumentation Facility. Kredit:Ruksana Baby For at kvantificere præcis, hvor kløende en
3-D-billeder af stofsandwich kan hjælpe med at måle tekstilfriktionEt vævet stofoverfladeanalysebillede taget fra Xradia 510 Versa 3D XRM-CT placeret på NC State Analytical Instrumentation Facility. Kredit:Ruksana Baby For at kvantificere præcis, hvor kløende en
- Forskning tyder på, hvordan turbulens kan bruges til at generere mønstre
- Hvorfor er Palisade -cellen speciel?
- Hvad er en HBCU? Alt hvad du behøver at vide om historisk sorte gymnasier eller universiteter
- Stigende havtemperaturer vil ramme fiskeri og samfund i fattige lande hårdest
- Nye materialer til bæredygtige, lavpris batterier
- Undersøgelse:Mangfoldighedsunderskud i amerikansk teknologisk arbejdsstyrke


