Hvad er osmolariteten på 10,00 gram aluminiumsulfat opløst i 200 ml vandig opløsning?
1. Bestem molekylvægten af aluminiumssulfat (Al₂ (SO₄) ₃)
* Al:26,98 g/mol (atomvægt) x 2 =53,96 g/mol
* S:32,06 g/mol x 3 =96,18 g/mol
* O:16,00 g/mol x 12 =192,00 g/mol
Samlet molekylvægt =53,96 + 96,18 + 192,00 = 342,14 g/mol
2. Beregn antallet af mol aluminiumssulfat
* Mol =masse / molekylvægt
* Mol =10,00 g / 342,14 g / mol =0,0292 mol
3. Bestem antallet af producerede ioner pr. Molekyle
* Aluminiumsulfat dissocieres i 2 aluminiumioner (al³⁺) og 3 sulfationer (SO₄²⁻) for i alt 5 ioner pr. Molekyle.
4. Beregn osmolariteten
* Osmolaritet =(antal mol opløst x antal ioner pr. Molekyle) / volumen af opløsning (i liter)
* Osmolaritet =(0,0292 mol x 5) / 0,200 l = 0,730 OSM
Derfor er osmolariteten af en 10,00 g aluminiumsulfatopløsning i 200 ml vand 0,730 OSM.
 Varme artikler
Varme artikler
-
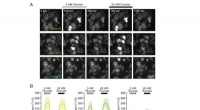 Grønne fluorescerende proteinbaserede glukoseindikatorer til overvågning af glukosemetabolisme i r…A:Billeder af HeLa -celler, der udtrykker Green Glifon50, Grøn Glifon600 og Grøn Glifon4000. Skalaen repræsenterer 20 μm. B:Ændringer i fluorescensintensitet (FI) i HeLa -celler, der udtrykker de tre
Grønne fluorescerende proteinbaserede glukoseindikatorer til overvågning af glukosemetabolisme i r…A:Billeder af HeLa -celler, der udtrykker Green Glifon50, Grøn Glifon600 og Grøn Glifon4000. Skalaen repræsenterer 20 μm. B:Ændringer i fluorescensintensitet (FI) i HeLa -celler, der udtrykker de tre -
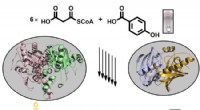 Biosyntese af udbredte pigmenter fra bakterier afsløretBiosyntese af de gule arylpolyen beskyttende pigmenter fra simple forstadier, der er meget udbredt i bakterier. Kredit:Maximilian Schmalhofer Bakterier kan beskytte sig mod angreb af frie radikale
Biosyntese af udbredte pigmenter fra bakterier afsløretBiosyntese af de gule arylpolyen beskyttende pigmenter fra simple forstadier, der er meget udbredt i bakterier. Kredit:Maximilian Schmalhofer Bakterier kan beskytte sig mod angreb af frie radikale -
 Tryk kan være nøglen til at bekæmpe klimaændringer med termoelektriske generatorerKunstners opfattelse af, hvordan påføring af tryk i diamantamboltcellen ændrer den elektroniske struktur af bly -selenid. Kredit:Xiao-Jia Chen Tryk forbedrer materialers evne til at omdanne varme
Tryk kan være nøglen til at bekæmpe klimaændringer med termoelektriske generatorerKunstners opfattelse af, hvordan påføring af tryk i diamantamboltcellen ændrer den elektroniske struktur af bly -selenid. Kredit:Xiao-Jia Chen Tryk forbedrer materialers evne til at omdanne varme -
 Forskningskonsortium producerer 3D-kort i høj opløsning over GLP-1RStrukturer af humane GLP-1 og glucagon receptorer, vigtige lægemiddelmål for diabetes og fedme. Kredit:ShanghaiTech University Et internationalt team ledet af iHuman Institute, ShanghaiTech Univer
Forskningskonsortium producerer 3D-kort i høj opløsning over GLP-1RStrukturer af humane GLP-1 og glucagon receptorer, vigtige lægemiddelmål for diabetes og fedme. Kredit:ShanghaiTech University Et internationalt team ledet af iHuman Institute, ShanghaiTech Univer
- Hvordan transformeres energi under fotosyntesen?
- Klimaændringer et strategisk dilemma for den Persiske Golf, siger ekspert
- Er det en fysisk ændring eller kemikalie, når filtrat fordampes til tørhed?
- Er lioh plus hcl lig med licl h2o en syrebase?
- Sådan tager du et billede af lyspuls
- Hvorfor er DNA livets udskrift?


