Når du sænker pH -værdien af en opløsning, der indeholder vandigt natriumbenzoatudfældning, danner til sidst det, der vil ske, hvis det derefter hæves efter reaktion ved at tilføje NaOH?
1. Sænkning af pH:
* reaktion: Når du sænker pH i en opløsning, der indeholder natriumbenzoat (NAC 7 H 5 O 2 ), du tilsætter i det væsentlige syre (h + ). Denne syre reagerer med benzoatanionen (C 7 H 5 O 2 - ) at danne benzoesyre (C 7 H 6 O 2 ):
`` `
C 7 H 5 O 2 - (aq) + h + (aq) ⇌ c 7 H 6 O 2 (aq)
`` `
* nedbør: Benzoesyre er en svag syre og er mindre opløselig i vand end dens saltform, natriumbenzoat. Når koncentrationen af benzoesyre øges, når den sin opløselighedsgrænse og udfælder ud af opløsningen som et hvidt fast stof.
2. Hæver pH:
* reaktion: Tilføjelse af NaOH til opløsningen øger pH (gør den mere grundlæggende). Hydroxidionerne (OH - ) fra NaOH reagerer med benzoinsyren og konverterer den tilbage til benzoationer:
`` `
C 7 H 6 O 2 (aq) + oh - (aq) ⇌ c 7 H 5 O 2 - (aq) + h 2 O (l)
`` `
* opløsning: Når koncentrationen af benzoationer øges, opløses benzoesyreforfærningen. Dette skyldes, at ligevægten skifter tilbage mod dannelsen af de mere opløselige benzoationer.
Kortfattet:
Ved at sænke pH skaber du et miljø, der favoriserer dannelsen af benzoesyre, hvilket fører til nedbør. Ved at hæve pH igen skifter du ligevægten tilbage til dannelsen af benzoationer, hvilket får bundfaldet til at opløses.
 Varme artikler
Varme artikler
-
 Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit
Forskere rapporterer om ny klasse af polyethylenkatalysatorerOlafs Daugulis, Robert A. Welch Chair of Chemistry ved University of Houston, ledet et team, der opdagede en ny klasse af katalysatorer til fremstilling af ultra-højvægts polyethylen. Kredit:Universit -
 Frysrammemikroskopi indfanger molekyler, der låses og belastes af DNATranskriptionsfaktor IID -komplekset låser sig på DNA, kontrollerer, at det er det rigtige sted og rekrutterer derefter andre proteiner til at begynde at transkribere DNA til RNA. Nye fremskridt inden
Frysrammemikroskopi indfanger molekyler, der låses og belastes af DNATranskriptionsfaktor IID -komplekset låser sig på DNA, kontrollerer, at det er det rigtige sted og rekrutterer derefter andre proteiner til at begynde at transkribere DNA til RNA. Nye fremskridt inden -
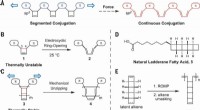 Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B)
Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B) -
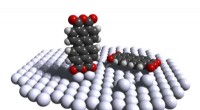 Tricky feat med stand-up molekyleOprejst PTCDA -molekyle på en sølvplatform (til venstre); normalt aflejres molekylet fladt mod det flade lag af sølvatomer (til højre). Kredit:Forschungszentrum Jülich / T. Esat I de seneste årtie
Tricky feat med stand-up molekyleOprejst PTCDA -molekyle på en sølvplatform (til venstre); normalt aflejres molekylet fladt mod det flade lag af sølvatomer (til højre). Kredit:Forschungszentrum Jülich / T. Esat I de seneste årtie


