Er dinitrogen hexaiodidionisk eller molekylær?
* Naturen af elementerne: Nitrogen og jod er begge ikke -metaller. Ikke -metaller danner typisk kovalente bindinger ved at dele elektroner.
* Elektronegativitetsforskel: Elektronegativitetsforskellen mellem nitrogen og jod er ikke stor nok til at skabe en signifikant ionisk karakter i bindingerne. Dette betyder, at elektronerne deles, ikke fuldt ud overført, hvilket indikerer en kovalent binding.
På trods af tilstedeværelsen af en polyatomisk kation (N₂⁶⁺) og en anion (i⁻) i formlen betragtes den samlede struktur af dinitrogen hexaiodid som molekylær på grund af bindingens kovalente karakter.
Sidste artikelHvad hedder ionisk sammensat CR2S3?
Næste artikelLithium valenselektroner type ioner dannet?
 Varme artikler
Varme artikler
-
 Ny metode opdager hurtigt spormængder af små molekyle forbindelserKredit:@Lion_on_helium/MIPT Russiske forskere fra Prokhorov General Physics Institute of the Russian Academy of Sciences (GPI RAS) og Moskva Institute of Physics and Technology (MIPT) har udviklet
Ny metode opdager hurtigt spormængder af små molekyle forbindelserKredit:@Lion_on_helium/MIPT Russiske forskere fra Prokhorov General Physics Institute of the Russian Academy of Sciences (GPI RAS) og Moskva Institute of Physics and Technology (MIPT) har udviklet -
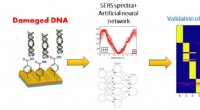 Forskere får neurale netværk til at opdage DNA-skader forårsaget af UV-strålingSkematisk diagram af SERS-sensorens drift i kombination med det neurale netværk til analyse af DNA-skader. Kredit:TPU Forskere ved Tomsk Polytekniske Universitet udførte sammen med Universitetet f
Forskere får neurale netværk til at opdage DNA-skader forårsaget af UV-strålingSkematisk diagram af SERS-sensorens drift i kombination med det neurale netværk til analyse af DNA-skader. Kredit:TPU Forskere ved Tomsk Polytekniske Universitet udførte sammen med Universitetet f -
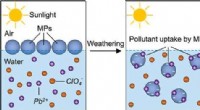 Forskere tager fat på miljøforvitring af mikroplast, optagelse af forurenende stofferGrafisk abstrakt. Kredit:ACS Environmental Au (2022). DOI:10.1021/acsenvironau.2c00036 I et nyt papir fra fakultet og studerende i LSU Chemical Engineering and Chemistry offentliggjort i ACS Enviro
Forskere tager fat på miljøforvitring af mikroplast, optagelse af forurenende stofferGrafisk abstrakt. Kredit:ACS Environmental Au (2022). DOI:10.1021/acsenvironau.2c00036 I et nyt papir fra fakultet og studerende i LSU Chemical Engineering and Chemistry offentliggjort i ACS Enviro -
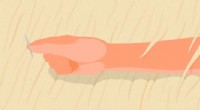
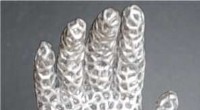 Forskning i flydende metal påberåber Terminator -film - men meget venligereEn hånd, der langsomt åbner sig, når metalgitteret smelter. Kredit:Pu Zhang Pu Zhang kan lide at sammenligne sit teams forskning om flydende metaller med Terminator - specifikt 1991s Terminator 2:
Forskning i flydende metal påberåber Terminator -film - men meget venligereEn hånd, der langsomt åbner sig, når metalgitteret smelter. Kredit:Pu Zhang Pu Zhang kan lide at sammenligne sit teams forskning om flydende metaller med Terminator - specifikt 1991s Terminator 2:
- 30 nuancer af stål:Forskere udvikler snydeark til skabelsen af nye stål
- Hvad er alle de forskellige slags metal?
- Transformationen af et par:Hvordan elektroner supertransporterer strøm i dårlige metaller
- Sammenlign og kontrast de tre typer magma?
- Et kraftboost til mobile teknologier
- Hvordan vil milliarder af marine mikrober tilpasse sig klimaændringer?


