Hvorfor kombineres sølvnitrat først med chloridioner i vand og ikke K2Cro4?
Her er hvorfor:
* opløselighed: Opløselighed henviser til den maksimale mængde af et stof, der kan opløses i et givet opløsningsmiddel ved en bestemt temperatur.
* dannelse af bundfald: Når et stofs opløselighed overskrides, udfældes det ud af opløsningen som et fast stof.
* Relative opløseligheder: AGCL er praktisk talt uopløselig i vand (meget lav opløselighed), mens ag₂cro₄ er lidt opløselig (hvilket betyder, at et lille beløb opløses).
I en løsning, der indeholder både cl⁻ og cro₄²⁻ -ioner, sker følgende:
1. Agno₃ dissocierer: Agno₃ opløses i vand og frigiver ag⁺ og ingen ioner.
2. AGCL -dannelse: Ag⁺ionerne reagerer straks med Cl⁻ioner og danner fast AgCl, som udfælder ud af opløsningen på grund af dens ekstremt lave opløselighed.
3. Ag₂cro₄ -dannelse: De resterende ag⁺ioner reagerer derefter med cro₄²⁻ -ioner til dannelse af ag₂cro₄. Da ag₂cro₄ imidlertid er lidt opløselig, opløses en lille mængde og forbliver i opløsning, mens resten udfældes.
Derfor dannes AGCL først, fordi dens lave opløselighed driver reaktionen på færdiggørelse, hvilket effektivt fjerner AG⁺ioner fra løsningen og forhindrer dannelse af betydelige mængder af ag₂cro₄.
 Varme artikler
Varme artikler
-
 Akemikere låser op for hemmeligheder bag smeltede salteComputerkemiker Yu Shi fra University of Cincinnati. Kredit:Andrew Higley, University of Cincinnati En kemiker ved University of Cincinnati har fundet på en ny måde at studere de termodynamiske ege
Akemikere låser op for hemmeligheder bag smeltede salteComputerkemiker Yu Shi fra University of Cincinnati. Kredit:Andrew Higley, University of Cincinnati En kemiker ved University of Cincinnati har fundet på en ny måde at studere de termodynamiske ege -
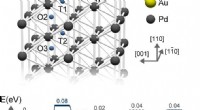 Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagringAu-atomerne destabiliserer kemisorberet brint, dermed øge deres energi og reducere barrieren. Kredit:2018 Shohei Ogura, Institut for Industrividenskab, Universitetet i Tokyo Materialer, der absorb
Hvorfor guld-palladium-legeringer er bedre end palladium til brintlagringAu-atomerne destabiliserer kemisorberet brint, dermed øge deres energi og reducere barrieren. Kredit:2018 Shohei Ogura, Institut for Industrividenskab, Universitetet i Tokyo Materialer, der absorb -
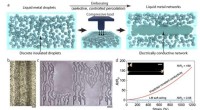 Selvhelbredende flydende metal-elastomererSkaber robuste ledende spor. (a) Skema til at illustrere processen med prægning, hvor diskrete isolerende dråber af flydende metal er selektivt præget for at danne et forbundet ledende netværk. (b) Op
Selvhelbredende flydende metal-elastomererSkaber robuste ledende spor. (a) Skema til at illustrere processen med prægning, hvor diskrete isolerende dråber af flydende metal er selektivt præget for at danne et forbundet ledende netværk. (b) Op -
 Ny software bringer cryo-EM-kort i lavere opløsning i fokusEt eksempel på den sekundære strukturdetektering i cryo-EM-densitetskort ved hjælp af Emap2Sec. Til venstre er et EM-kort over archaeal 20S proteasom (EMDB ID:EMD-1733). Til højre er detekteret sekund
Ny software bringer cryo-EM-kort i lavere opløsning i fokusEt eksempel på den sekundære strukturdetektering i cryo-EM-densitetskort ved hjælp af Emap2Sec. Til venstre er et EM-kort over archaeal 20S proteasom (EMDB ID:EMD-1733). Til højre er detekteret sekund
- Asymmetri i CO2-emissioner og -fjernelser kan skævvride klimamålene:forskning
- Ny undersøgelse afdækker interaktionen mellem calciumkanaler
- Hvordan regulerer planter deres sukkerstofskifte?
- At forstå, hvordan små organiske ioner stabiliserer guldnanopartikler, kan give bedre kontrol
- Er der nogen måde at se satellitter, der er i kredsløb?
- Du bor inde i et massivt musikinstrument – og her er, hvordan det lyder


