Hvordan tegner du to isotoper af kulstof og giver massenummeret for hver?
Forståelse af isotoper
* isotoper er atomer med det samme element (samme antal protoner), men med forskellige antal neutroner. Denne forskel i neutroner fører til forskellige massetal.
Tegning af kulstofisotoper
1. carbon-12 (¹²c)
* Protoner: 6 (alle carbonatomer har 6 protoner)
* neutroner: 6 (massetal - antal protoner =12 - 6 =6)
* Elektroner: 6 (atomer er neutrale, så de har det samme antal protoner og elektroner)
* tegning:
* kerne: Tegn en cirkel, der repræsenterer kernen. Indvendigt skriv "6p" til protonerne og "6n" for neutronerne.
* Elektronskaller: Tegn to koncentriske cirkler omkring kernen for at repræsentere elektronskaller. I den første skal skal du placere 2 prikker. I den anden skal skal du placere 4 prikker.
2. carbon-14 (¹⁴c)
* Protoner: 6 (alle carbonatomer har 6 protoner)
* neutroner: 8 (massetal - antal protoner =14 - 6 =8)
* Elektroner: 6 (atomer er neutrale, så de har det samme antal protoner og elektroner)
* tegning:
* kerne: Tegn en cirkel, der repræsenterer kernen. Indvendigt skriv "6p" til protonerne og "8n" for neutronerne.
* Elektronskaller: Tegn to koncentriske cirkler omkring kernen for at repræsentere elektronskaller. I den første skal skal du placere 2 prikker. I den anden skal skal du placere 4 prikker.
Vigtige noter:
* Massenummer: Massenummeret er det samlede antal protoner og neutroner i en atoms kerne. Det er skrevet som et superscript til venstre for elementsymbolet.
* Elektronkonfiguration: Begge isotoper af kulstof har den samme elektronkonfiguration, fordi de har det samme antal elektroner. Dette betyder, at de har de samme kemiske egenskaber.
* Radioaktivitet: Carbon-14 er en radioaktiv isotop, hvilket betyder, at dens kerne er ustabil og nedbrydes over tid. Carbon-12 er en stabil isotop.
 Varme artikler
Varme artikler
-
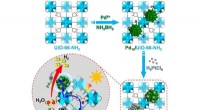 Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu
Enkeltatomlegering:Fremragende cokatalysator til fotokatalyseOverfladeladningstilstanden af co-katalysator spiller en vigtig rolle i fotokatalyse. Imidlertid, forordningen om overfladeladningstilstand for co-katalysatorer, især ved at ændre deres mikrostruktu -
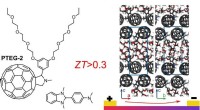 Gør varme til strøm med effektivt organisk termoelektrisk materialeDen kemiske struktur af fullerenderivatet, der anvendes i vores arbejde, forbedrer rækkefølgen af molekylerne som vist (til højre) i snapshots af den molekylære pakning. Ved at bruge et passende dop
Gør varme til strøm med effektivt organisk termoelektrisk materialeDen kemiske struktur af fullerenderivatet, der anvendes i vores arbejde, forbedrer rækkefølgen af molekylerne som vist (til højre) i snapshots af den molekylære pakning. Ved at bruge et passende dop -
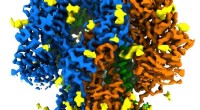 Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirusDette billede viser den detaljerede struktur af en spids fra en coronavirus, der forårsager forkølelsessymptomer - en mildere slægtning til den virus, der forårsager COVID-19. Pigge binder sig til rec
Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirusDette billede viser den detaljerede struktur af en spids fra en coronavirus, der forårsager forkølelsessymptomer - en mildere slægtning til den virus, der forårsager COVID-19. Pigge binder sig til rec -
 Kontrolleret frigivelse af gødning ved hjælp af biopolymerspånerLandbrugsjord i Tyskland får ofte langt mere gødning, end der reelt er behov for. Kredit:Roberto Schirdewahn I Tyskland, grænseværdierne for nitratforurening er gentagne gange blevet overskredet,
Kontrolleret frigivelse af gødning ved hjælp af biopolymerspånerLandbrugsjord i Tyskland får ofte langt mere gødning, end der reelt er behov for. Kredit:Roberto Schirdewahn I Tyskland, grænseværdierne for nitratforurening er gentagne gange blevet overskredet,
- Undersøgelse afslører, hvordan monarksommerfugle rekoloniserer det nordlige yngleområde
- Hvad hvis der ikke var nogen mineraler?
- Pennsylvania korrelerer fracking af naturgas med jordskælv
- Hvordan kan DNA -hybridisering give et mål for genetisk relaterethed mellem arter?
- Hvordan måles temperaturen af væske i olietankskib?
- Drone forstyrrer flyrejser fra Dubai


