Når aluminiumsfolie reagerer med kobber II -sulfat, hvad er produktet?
2al (s) + 3cuso₄ (aq) → Al₂ (so₄) ₃ (aq) + 3cu (s)
Her er en sammenbrud af, hvad der sker:
* aluminium (AL) er mere reaktiv end kobber (Cu). Dette betyder, at aluminium har en stærkere tendens til at miste elektroner.
* kobber (ii) sulfat (cuso₄) er et opløseligt salt, hvilket betyder, at det opløses i vand til dannelse af kobber (II) ioner (Cu²⁺) og sulfationer (SO₄²⁻).
* reaktionen er en enkelt forskydningsreaktion, hvor aluminium fortrænger kobber fra dens opløsning. Aluminiumatomer mister elektroner og danner aluminiumioner (al³⁺).
* kobberioner (cu²⁺) Få elektroner og bliver faste kobber (Cu) atomer, der udfælder ud af opløsningen.
* aluminiumssulfat (al₂ (so₄) ₃) dannes som et opløseligt salt, der forbliver i opløsning.
i enklere termer:
Aluminiumsfolien reagerer med kobber (II) sulfatopløsningen, hvilket resulterer i:
* dannelse af fast kobber På aluminiumsfolien, hvilket giver den en rødbrun belægning.
* aluminiumsulfat Opløsning i opløsningen.
Du kan observere denne reaktion visuelt:
* Den blå farve på kobber (II) sulfatopløsningen falmer, når kobberionerne forbruges.
* Aluminiumsfolien bliver belagt med et rødbrunt lag af kobber.
 Varme artikler
Varme artikler
-
 Sådan forvandler du plastikaffald i din papirkurv til profitGemt fra skraldespanden og klar til forvandling. Kredit:Nathan Shaiyen/Michigan Tech, CC BY Folk vil genbruge, hvis de kan tjene penge på det. På steder, hvor der tilbydes kontanter til dåser og f
Sådan forvandler du plastikaffald i din papirkurv til profitGemt fra skraldespanden og klar til forvandling. Kredit:Nathan Shaiyen/Michigan Tech, CC BY Folk vil genbruge, hvis de kan tjene penge på det. På steder, hvor der tilbydes kontanter til dåser og f -
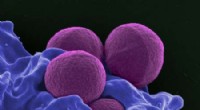 Ikke flere superbugs? Ahornsirup ekstrakt forbedrer den antibiotisk virkningEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Antibiotika redder liv hver dag, men der er en ulempe ved deres allestedsnærværende. Høje
Ikke flere superbugs? Ahornsirup ekstrakt forbedrer den antibiotisk virkningEn farvet scanningselektronmikrograf af MRSA. Kredit:National Institute of Allergy and Infectious Diseases Antibiotika redder liv hver dag, men der er en ulempe ved deres allestedsnærværende. Høje -
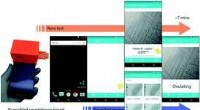 Forskere udvikler smartphone-baseret ægløsningstestKredit: Lab on a Chip (2018). DOI:10.1039/C8LC00792F Efterforskere fra Brigham and Womens Hospital er ved at udvikle en automatiseret, lavprisværktøj til at forudsige en kvindes ægløsning og hjæl
Forskere udvikler smartphone-baseret ægløsningstestKredit: Lab on a Chip (2018). DOI:10.1039/C8LC00792F Efterforskere fra Brigham and Womens Hospital er ved at udvikle en automatiseret, lavprisværktøj til at forudsige en kvindes ægløsning og hjæl -
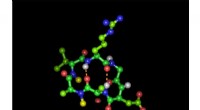 Den hellige gral af peptidkemi:Gør peptidaktive midler tilgængelige oraltCyklisk hexapeptid i sin bioaktive form med den integrinbindende tripeptidsekvens arginin-glycin-asparaginsyre:Grønne kugler repræsenterer carbonatomer, røde iltatomer, blå nitrogenatomer og hvide bri
Den hellige gral af peptidkemi:Gør peptidaktive midler tilgængelige oraltCyklisk hexapeptid i sin bioaktive form med den integrinbindende tripeptidsekvens arginin-glycin-asparaginsyre:Grønne kugler repræsenterer carbonatomer, røde iltatomer, blå nitrogenatomer og hvide bri
- Var det bedste kort i verden over tusind år gammel 1420?
- Låser teknologien op for at producere ubrydelige skærme
- Kan nukleart brændsel bruges til rumskibe?
- Hvorfor er videnskab overalt?
- Pumpe smeltevand tilbage på Antarktis? Har du 850.000 vindmøller?
- Ny forskning påviser forbindelser mellem klimaændringer og civile uroligheder blandt de gamle Maya


