Hvordan gør natriumchlorid vandtemperatur koldere?
Her er hvorfor:
* Opløsning er en eksoterm proces: Når salt opløses i vand, frigiver det en lille mængde varme i det omgivende vand. Dette skyldes, at den energi, der kræves for at bryde saltkrystallerne fra hinanden (endotermisk proces), er lidt mindre end den frigivne energi, når saltionerne interagerer med vandmolekylerne (eksoterme proces).
* Temperaturændringen er ubetydelig: Varmen frigivet under saltopløsning er meget lille, og den samlede temperaturændring er normalt ikke mærkbar.
* Effekten af salt på frysepunktet: Salt sænker det frysepunkt for vand, hvilket gør det sværere for vand at fryse. Dette er grunden til, at salt bruges på veje og fortove om vinteren. Dette er dog ikke det samme som at gøre vandet koldere.
Kortfattet: Opløsning af salt i vand frigiver en lille mængde varme, hvilket forårsager en svag stigning i temperaturen. Mens salt sænker vandets frysepunkt, gør det ikke selve vandet koldere.
Sidste artikelHvorfor er oxidations- og reduktionsprocesser komplementære?
Næste artikelHvad er sammenhængen mellem CO2 og temperatur?
 Varme artikler
Varme artikler
-
 Forskere bruger hele levende celler som skabeloner til at søge efter bioaktive molekylerHuman lungeadeconarcinomcelle brugt i denne forskning. Kredit:Daniel Carbajo En undersøgelse udført af forskere ved Institute for Advanced Chemistry of Catalonia (IQAC) fra det spanske nationale f
Forskere bruger hele levende celler som skabeloner til at søge efter bioaktive molekylerHuman lungeadeconarcinomcelle brugt i denne forskning. Kredit:Daniel Carbajo En undersøgelse udført af forskere ved Institute for Advanced Chemistry of Catalonia (IQAC) fra det spanske nationale f -
 Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork
Forskere får et atomistisk billede af platinkatalysatornedbrydningRøntgendiffraktionsopsætning ved ID31-strålelinje, European Synchrotron Radiation Facility. Kredit:Natalie Stubb Nedbrydning af platin, bruges som et nøgleelektrodemateriale i brintøkonomien, fork -
 Computermodel kan hjælpe forskere med at skille sig op, gensamle proteiner på kommandoKredit:CC0 Public Domain At skilles og finde sammen igen er altid svært at gøre, men for proteiner, det er næsten umuligt. Imidlertid, en computerstyret algoritme kan hjælpe videnskabsmænd med at
Computermodel kan hjælpe forskere med at skille sig op, gensamle proteiner på kommandoKredit:CC0 Public Domain At skilles og finde sammen igen er altid svært at gøre, men for proteiner, det er næsten umuligt. Imidlertid, en computerstyret algoritme kan hjælpe videnskabsmænd med at -
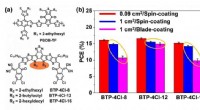 Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
Organisk fotovoltaisk celle med 17% effektivitet og overlegen bearbejdelighed til belægning i stort…(a) Molekylære strukturer af PBDB-TF og BTP-4Cl-X, X repræsenterer 8, 12 eller 16. b) statistik over OPV -celle under forskellige forberedelsesbetingelser. Kredit:Science China Press Organiske fot
- Når det kommer til at bruge naturressourcer, er der to hovedproblemer, som folk står overfor. Hvad…
- Hvad er størrelsen af lerjord?
- ultrarød, støvede stjernedannende galakser i det tidlige univers
- Magnetisk felt hjælper tykke batterielektroder med at tackle elektriske køretøjsudfordringer
- NASA ser orkanen Irma påvirke det sydlige Florida
- Geotermisk energilagringssystem for at reducere spidsbelastningen af elektricitet


