Hvorfor er oxidations- og reduktionsprocesser komplementære?
* Elektronoverførsel: Det grundlæggende grundlag for oxidation og reduktion er overførslen af elektroner.
* Oxidation: Et stof mister elektroner (bliver mere positive).
* reduktion: Et stof får elektroner (bliver mere negative).
* bevarelse af gebyr: Da elektroner er grundlæggende partikler med en negativ ladning, skal den samlede ladning i et system forblive afbalanceret. Hvis et atom eller molekyle mister elektroner (oxidation), skal en anden få disse elektroner (reduktion).
* redoxreaktioner: Den samtidige overførsel af elektroner er kendt som en redox -reaktion . Disse reaktioner er vigtige for mange biologiske og kemiske processer, herunder:
* Cellulær respiration: Processen med at nedbryde mad for at producere energi involverer overførsel af elektroner.
* Fotosyntese: Planter bruger sollys til at omdanne kuldioxid og vand til glukose, som involverer elektronoverførsel.
* Korrosion: Rusten af jern er en redoxreaktion.
* forbrænding: Brændingen af brændstof er en redoxreaktion.
Eksempel:
Overvej den enkle reaktion af magnesiummetal med saltsyre:
* mg (s) + 2HCl (aq) → mgcl2 (aq) + h2 (g)
I denne reaktion:
* magnesium (mg) oxideres:det mister to elektroner til at blive Mg²⁺.
* brint (H) er reduceret:Det får et elektron til at blive H₂.
Tabet af elektroner med magnesium er netop afbalanceret af forstærkningen af elektroner med brint. Dette er grunden til, at oxidation og reduktion altid er koblet.
I det væsentlige er oxidation og reduktion to sider af den samme mønt. Man kan ikke forekomme uden den anden, sikre bevarelse af ladning og drive en lang række kemiske reaktioner.
 Varme artikler
Varme artikler
-
 Forståelse af iltreducerende enzymerBilleder af F420H2-oxidasekrystaller opnået aerobt med en typisk størrelse på 0,1 mm. Med ilt giver Fe og flavin inde i enzymet den naturlige gule farve til krystallerne. Kredit:Max Planck Institute f
Forståelse af iltreducerende enzymerBilleder af F420H2-oxidasekrystaller opnået aerobt med en typisk størrelse på 0,1 mm. Med ilt giver Fe og flavin inde i enzymet den naturlige gule farve til krystallerne. Kredit:Max Planck Institute f -
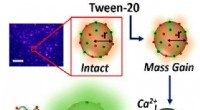 Forskere afslører, hvordan vaskemidler faktisk virkerGrafisk abstrakt. Kredit:The Journal of Physical Chemistry Letters (2022). DOI:10.1021/acs.jpclett.2c00704 Forskere har opdaget den præcise måde, hvorpå rengøringsmidler bryder biologiske membraner
Forskere afslører, hvordan vaskemidler faktisk virkerGrafisk abstrakt. Kredit:The Journal of Physical Chemistry Letters (2022). DOI:10.1021/acs.jpclett.2c00704 Forskere har opdaget den præcise måde, hvorpå rengøringsmidler bryder biologiske membraner -
 En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni
En billigere måde at opskalere atomlagsaflejring påKunstnerisk illustration af atomlagsaflejring. Kredit:J. Luterbacher Kemiingeniører ved EPFL har udviklet en ny metode til atomlagsaflejring, en teknik, der almindeligvis anvendes i mikroelektroni -
 Crowd-olie-brændstoffer fra klimaanlægKredit:CC0 Public Domain Forskere ved Karlsruhe Institute of Technology (KIT) og University of Toronto har foreslået en metode, der gør det muligt for klimaanlæg og ventilationssystemer at produce
Crowd-olie-brændstoffer fra klimaanlægKredit:CC0 Public Domain Forskere ved Karlsruhe Institute of Technology (KIT) og University of Toronto har foreslået en metode, der gør det muligt for klimaanlæg og ventilationssystemer at produce
- Russisk Soyuz-raket opsender 34 nye britiske satellitter
- En revolutionerende atomtynd halvleder til elektronik
- Alvorlige tørke i Caribien kan forstærke fødevaresikkerhed
- Hvad er den cirkonfrens af jorden?
- Hvad vil der ske, hvis du bruger fase til spænding til en enkelt enhed?
- Har ordet naturen en lang eller kort vokallyd?


