Hvilket volumen brint ved STP produceres fra reaktionen 50,0 g mg og tilsvarende 75 HCI?
1. Skriv den afbalancerede kemiske ligning:
MG (S) + 2HCI (AQ) → MGCL₂ (AQ) + H₂ (G)
2. Bestem den begrænsende reaktant:
* mol mg:
* Molmasse Mg =24,31 g/mol
* Mol mg =(50,0 g) / (24,31 g / mol) =2,06 mol
* mol HCL:
* Antag "ækvivalent" betyder lige mol HCL som Mg.
* Mol HCl =2,06 mol
* støkiometri: Den afbalancerede ligning viser et forhold på 1:1 mol mellem Mg og H₂. Da vi har lige mol mg og HCI, er Mg den begrænsende reaktant, fordi den først vil blive konsumeret.
3. Beregn mol af h₂ produceret:
* Ved anvendelse af molforholdet fra den afbalancerede ligning producerer 1 mol mg 1 mol H₂.
* Mol H₂ =2,06 mol mg × (1 mol H₂ / 1 mol mg) =2,06 mol H₂
4. Beregn mængden af H₂ på STP:
* Ved STP (standardtemperatur og tryk:0 ° C og 1 atm) optager 1 mol af enhver ideel gas 22,4 L.
* Volumen af H₂ =2,06 mol H₂ × (22,4 L/mol) = 46,1 L
Derfor produceres 46,1 L brintgas ved STP fra reaktionen på 50,0 g mg og tilsvarende 75 HCI.
Sidste artikelHvilke tre produkter dannes ved elektrolyse af vandigt cæsiumbromid?
Næste artikelHvad klassificeres ilt som?
 Varme artikler
Varme artikler
-
 Nye syntetiske proteiner konkurrerer med deres naturlige modstykker inden for protontransportForskere skabte en ny polymer, der er lige så effektiv som naturlige proteiner til at transportere protoner gennem en membran. Kredit:ORNL/Jill Hemman Biologiske membraner, såsom vægge i de fleste
Nye syntetiske proteiner konkurrerer med deres naturlige modstykker inden for protontransportForskere skabte en ny polymer, der er lige så effektiv som naturlige proteiner til at transportere protoner gennem en membran. Kredit:ORNL/Jill Hemman Biologiske membraner, såsom vægge i de fleste -
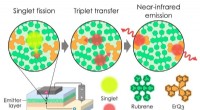 Exciton-grænser er beregnet til at blive brudt:OLED overgår 100 procent exciton-produktionseffekti…Illustration af singlet fissionsprocessen, der bruges til at øge antallet af excitoner i en OLED og bryde grænsen på 100 procent for excitonproduktionseffektivitet. Det emitterende lag består af en bl
Exciton-grænser er beregnet til at blive brudt:OLED overgår 100 procent exciton-produktionseffekti…Illustration af singlet fissionsprocessen, der bruges til at øge antallet af excitoner i en OLED og bryde grænsen på 100 procent for excitonproduktionseffektivitet. Det emitterende lag består af en bl -
 Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm
Forskere adskiller protein-nanopartikel-interaktioner, foreslå vej til lægemiddel-sensing værktø…Arbejde fra videnskabsmænd ved Rice og Stanford universiteter afslørede, at bovint serumalbuminproteiner får guld nanorods til at danne højrehåndede chirale samlinger, mens de producerer chirale plasm -
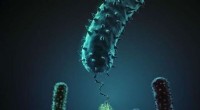 Bakteriel adhæsion in vitro og in silicoDenne figur viser, hvordan stafylokokker adhæsionsprotein (i grønt) interagerer med dets beslægtede peptidligand (rød). Kredit:H. Gaub, LMU München Ludwig-Maximilians-Universitaet (LMU) forskere
Bakteriel adhæsion in vitro og in silicoDenne figur viser, hvordan stafylokokker adhæsionsprotein (i grønt) interagerer med dets beslægtede peptidligand (rød). Kredit:H. Gaub, LMU München Ludwig-Maximilians-Universitaet (LMU) forskere
- Hvad betyder ploymineralic?
- Hvor er Zero -tyngdekraften på jordoverfladen?
- Ingen hurtig løsning tilgængelig for effektiv risikostyring i organisationer
- Nanopartikel-jamming ved vand-olie-grænsefladen
- Hvad er delene af et veludskrevet eksperiment?
- En ny krybdyrart fra Wales navngivet af Bristol-studerende


