Har brom et lavere kogepunkt end klor?
Her er hvorfor:
* Intermolekylære kræfter: Brom (Br₂) og chlor (CL₂) er begge diatomiske halogener. De oplever London -spredningskræfter, som er den svageste type intermolekylær kraft. Brom er imidlertid et større molekyle end klor.
* Større størrelse, stærkere kræfter: Den større størrelse af brom betyder, at dens elektronsky er mere polariserbar, hvilket fører til stærkere London -spredningskræfter. Stærkere intermolekylære kræfter kræver mere energi til at overvinde, hvilket resulterer i et højere kogepunkt.
kogepunkter:
* klor (cl₂): -34,04 ° C.
* brom (br₂): 58,8 ° C.
Derfor har brom en højere Kogepunkt end klor.
Sidste artikelHvad er valensen af N i NO2?
Næste artikelHvad er den afbalancerede ligning til at repræsentere nedbrydning af bly IV -oxid?
 Varme artikler
Varme artikler
-
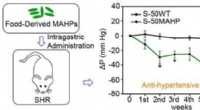 Transgene ris sænker blodtrykket hos hypertensive rotterKredit:American Chemical Society I fremtiden, at tage din blodtryksmedicin kunne være så simpelt som at spise en skefuld ris. Denne behandling kan også have færre bivirkninger end nuværende blodtr
Transgene ris sænker blodtrykket hos hypertensive rotterKredit:American Chemical Society I fremtiden, at tage din blodtryksmedicin kunne være så simpelt som at spise en skefuld ris. Denne behandling kan også have færre bivirkninger end nuværende blodtr -
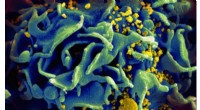 Fullerenforbindelser slår virusinfektioner som HIV og HSV udMikroskopisk billede af en HIV-inficeret T-celle. Kredit:NIAID Forskere fra Skoltech Center for Energividenskab og Teknologi og Institute of Problems of Chemical Physics of RAS har i samarbejde me
Fullerenforbindelser slår virusinfektioner som HIV og HSV udMikroskopisk billede af en HIV-inficeret T-celle. Kredit:NIAID Forskere fra Skoltech Center for Energividenskab og Teknologi og Institute of Problems of Chemical Physics of RAS har i samarbejde me -
 Brint:fremtidens brændstof?Da løbet om at finde energikilder til at erstatte vores faldende fossile brændstofforsyninger fortsætter i hast, brint vil sandsynligvis spille en afgørende rolle i fremtiden. Kredit:Materials Researc
Brint:fremtidens brændstof?Da løbet om at finde energikilder til at erstatte vores faldende fossile brændstofforsyninger fortsætter i hast, brint vil sandsynligvis spille en afgørende rolle i fremtiden. Kredit:Materials Researc -
 Grafen øger perovskite-enkeltkrystal-fotodetektorens ydeevneKredit:CC0 Public Domain På grund af den brede anvendelse af fotodetektorer inden for områder, herunder optisk kommunikation, miljøovervågning, og billedsansning, forskning i udvikling af højeffek
Grafen øger perovskite-enkeltkrystal-fotodetektorens ydeevneKredit:CC0 Public Domain På grund af den brede anvendelse af fotodetektorer inden for områder, herunder optisk kommunikation, miljøovervågning, og billedsansning, forskning i udvikling af højeffek
- Indsamling af små dråber til biomedicinsk analyse og videre
- Hvem er din far? Faderskabstests historie
- Hvad er stærkere diamant eller titanium?
- Nye NIST-tests udforsker sikkerheden ved nanorør i moderne plast over tid
- Kan du adskille en opløselig fra væske?
- Brandtunede topologiske isolatorer kan føre til nye platforme inden for bæredygtig kvanteelektroni…


