Hvordan skelner du mellem svovldioxid og trioxid?
1. Kemisk formel:
* svovldioxid (SO₂): Indeholder et svovlatom og to iltatomer.
* svovltrioxid (SO₃): Indeholder et svovlatom og tre iltatomer.
2. Fysisk tilstand ved stuetemperatur:
* svovldioxid (SO₂): En farveløs gas med en skarp, kvælende lugt.
* svovltrioxid (SO₃): Findes som en farveløs væske eller et hvidt fast stof.
3. Reaktivitet:
* svovldioxid (SO₂): En reaktiv gas, der opløses i vand til dannelse af svovlsyre (H₂so₃), en svag syre. Det fungerer som et reduktionsmiddel.
* svovltrioxid (SO₃): En meget reaktiv gas, der opløses i vand til dannelse af svovlsyre (H₂so₄), en stærk syre. Det fungerer som et oxidationsmiddel.
4. Anvendelser:
* svovldioxid (SO₂): Bruges til produktion af svovlsyre, som konserveringsmiddel i mad og vin, og som et blegemiddel.
* svovltrioxid (SO₃): Bruges primært til produktion af svovlsyre.
5. Miljøpåvirkning:
* svovldioxid (SO₂): Et stort luftforurenende stof, der bidrager til surt regn og luftvejsproblemer.
* svovltrioxid (SO₃): Bidrager også til sur regn, men dens største påvirkning er relateret til produktionen af svovlsyre.
Kortfattet:
De vigtigste forskelle ligger i deres kemiske sammensætning, fysiske tilstand, reaktivitet, anvendelser og miljøpåvirkning. Mens begge er svovloxider, er svovltrioxid et stærkere syre- og oxidationsmiddel, hvilket fører til dets primære anvendelse i svovlsyreproduktion. På den anden side er svovldioxid en mere alsidig forbindelse med forskellige anvendelser og en betydelig miljøpåvirkning.
Sidste artikelHvad er navnene, og hvor mange atomer i 2H2SO4?
Næste artikelHvad er den kemiske formel for AL203?
 Varme artikler
Varme artikler
-
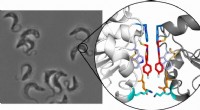 Ny terapeutisk tilgang til bekæmpelse af afrikansk sovesygeTrypanosomer, som forårsager afrikansk sovesyge, under mikroskopet (til venstre) og krystalstrukturen af tryparedoxin-dimeren (til højre):De to inhibitormolekyler er fremhævet med rødt. Kredit:Ute H
Ny terapeutisk tilgang til bekæmpelse af afrikansk sovesygeTrypanosomer, som forårsager afrikansk sovesyge, under mikroskopet (til venstre) og krystalstrukturen af tryparedoxin-dimeren (til højre):De to inhibitormolekyler er fremhævet med rødt. Kredit:Ute H -
 Forbedring af sammensætningen af strålebeskyttelsesbrillerForskere vælger den optimale sammensætning af briller, som vil have stærke beskyttende egenskaber, klarhed og miljøvenlighed. Kredit:UrFU / Anastasia Farafontova. Forskere ved Ural Federal Universi
Forbedring af sammensætningen af strålebeskyttelsesbrillerForskere vælger den optimale sammensætning af briller, som vil have stærke beskyttende egenskaber, klarhed og miljøvenlighed. Kredit:UrFU / Anastasia Farafontova. Forskere ved Ural Federal Universi -
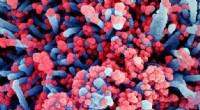 Forstå overfladekemien af SARS-CoV-2Farvelagt scanningselektronmikrofotografi af en celle (blå) stærkt inficeret med SARS-CoV-2-viruspartikler (rød), isoleret fra en patientprøve. Billede taget på NIAID Integrated Research Facility (IRF
Forstå overfladekemien af SARS-CoV-2Farvelagt scanningselektronmikrofotografi af en celle (blå) stærkt inficeret med SARS-CoV-2-viruspartikler (rød), isoleret fra en patientprøve. Billede taget på NIAID Integrated Research Facility (IRF -
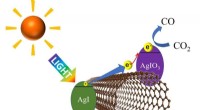 Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is
Brug af synligt lys til effektivt at nedbryde kuldioxidDen fotoeksciterede elektron fra sølviodid (AgI) bevæger sig langs kulnanorøret til sølviodat (AgIO 3 ) hvor kuldioxid (CO 2 ) reduceres til carbonmonoxid (CO). Kredit:Shinji Kawasaki og Yosuke Is
- Send denne side:Chrome 77 holder det enkelt
- Testprojekter, der er testet i 7. klasse, testes
- Orkanen Ian:Ældre voksne har mange grunde til ikke at evakuere. Hvorfor det er vigtigt at tjekke al…
- Hvad er der oxidationsnummer for nitrogen?
- Hvad slags fisk er en Mahi Mahi?
- Lille nedbør og ekstreme temperaturer er hovedegenskaber, som biome?


