Hvad er produkterne fra dobbeltudskiftningsreaktion mellem kaliumchlorid og sølvacetat?
1. Forstå dobbeltudskiftningsreaktioner
I en dobbeltudskiftningsreaktion skifter de positive og negative ioner af to reaktanter. Den generelle form er:
AB + CD → AD + CB
2. Identificer ionerne
* kaliumchlorid (KCL): K⁺ (kaliumion) og Cl⁻ (chloridion)
* sølvacetat (Agc₂h₃o₂): AG⁺ (sølvion) og c₂h₃o₂⁻ (acetation)
3. Skift partnere
* Kalium (k⁺) kombineres med acetat (c₂h₃o₂⁻) for at danne kaliumacetat (kc₂h₃o₂) .
* Sølv (AG⁺) kombineres med chlorid (CL⁻) for at danne sølvchlorid (AGCL) .
4. Den afbalancerede ligning
Den komplette afbalancerede kemiske ligning er:
KCL (aq) + Agc₂h₃o₂ (aq) → Kc₂h₃o₂ (aq) + AGCL (s)
Vigtig note:
* Sølvchlorid (AGCL) er et hvidt bundfald Det er uopløseligt i vand. Dette er grunden til, at det er repræsenteret som (er) for fast stof i ligningen.
* Det andet produkt, kaliumacetat (kc₂h₃o₂), er opløseligt i vand og forbliver opløst som ioner i opløsning (aq).
Derfor er produkterne fra dobbeltudskiftningsreaktionen mellem kaliumchlorid og sølvacetat kaliumacetat og sølvchlorid (bundfald).
 Varme artikler
Varme artikler
-
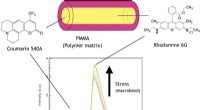 Polymerbaseret optisk fiber til visualisering af materialespændingOvergang af outputspektrum af en fluorophor-doteret polymer optisk fiber ved påført belastning. Kredit:University of Electro Communications Fiberoptisk strain sensing er kendt for sin evne til at
Polymerbaseret optisk fiber til visualisering af materialespændingOvergang af outputspektrum af en fluorophor-doteret polymer optisk fiber ved påført belastning. Kredit:University of Electro Communications Fiberoptisk strain sensing er kendt for sin evne til at -
 Ny reaktion vil gøre indolin stilladser tilgængelige til farmaceutisk udviklingFra venstre mod højre, Professor Donald A. Watson og ph.d. -studerende Feiyang Xu og Katerina Korch har fundet en ny, lettere måde at gøre komplekse kemiske strukturer kendt som indolin stilladser, de
Ny reaktion vil gøre indolin stilladser tilgængelige til farmaceutisk udviklingFra venstre mod højre, Professor Donald A. Watson og ph.d. -studerende Feiyang Xu og Katerina Korch har fundet en ny, lettere måde at gøre komplekse kemiske strukturer kendt som indolin stilladser, de -
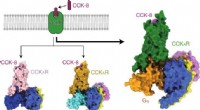 Mekanisme af virkninger af cholecystokinin-receptorer afsløretGrafisk abstrakt. Kredit:DOI:10.1038/s41589-021-00841-3 Cholecystokinin (CCK) og gastrin er de tidligst opdagede gastrointestinale hormoner. De er de mest udbredte peptider i mave-tarmkanalen og c
Mekanisme af virkninger af cholecystokinin-receptorer afsløretGrafisk abstrakt. Kredit:DOI:10.1038/s41589-021-00841-3 Cholecystokinin (CCK) og gastrin er de tidligst opdagede gastrointestinale hormoner. De er de mest udbredte peptider i mave-tarmkanalen og c -
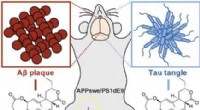 Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
Rodbakterie til at bekæmpe Alzheimers:Rhizolutin adskiller beta- og tau-aggregaterKredit: Angewandte Chemie International Edition En bakterie fundet i jorden tæt på rødderne af ginsengplanter kunne give en ny tilgang til behandling af Alzheimers. Rhizolutin, en ny klasse af fo
- Hvor mange kulstofatomer er der i et molekyle, hvis det har 12 oxygenatomer?
- Hvor skabes jordmagnetisk fe ild?
- Hvilket enzym er ansvarlig for at katalysere dannelsen af to nye DNA -strenge?
- Hvorfor du ikke bør se på en solformørkelse uden øjenbeskyttelse
- Store vulkanudbrud kan ændre orkanens styrke og hyppighed
- Deep Neural Network har til formål at forbedre billeddannelse af celler


