Mekanisme af virkninger af cholecystokinin-receptorer afsløret
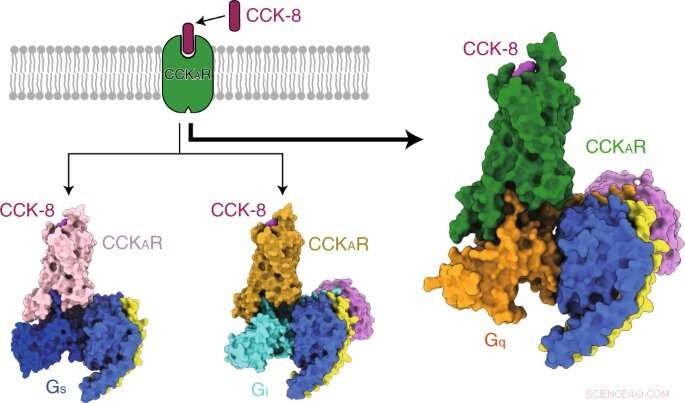
Grafisk abstrakt. Kredit:DOI:10.1038/s41589-021-00841-3
Cholecystokinin (CCK) og gastrin er de tidligst opdagede gastrointestinale hormoner. De er de mest udbredte peptider i mave-tarmkanalen og centralnervesystemet, fungerer som fysiologisk vigtige hormoner og neurotransmittere gennem to CCK-receptorundertyper, CCKAR og CCKBR.
Disse to receptorer engagerer sig i fundamentale fysiologiske handlinger såsom mæthedsregulering, bugspytkirtelens enzymsekretion, og sammentrækning af galdeblæren. De er også involveret i adfærdsmæssige processer, herunder angst, hukommelse, og stofmisbrug. Imidlertid, udviklingen af lægemidler mod cholecystokinin-receptorer (CCKR'er) er udfordrende hovedsageligt på grund af manglen på præcis strukturel information.
I to undersøgelser, begge offentliggjort i Naturens kemiske biologi , forskerholdet ledet af Jiang Yi, Wang Mingwei, H. Eric Xu, Zhao Qiang, og Wu Beili fra Shanghai Institute of Materia Medica fra det kinesiske videnskabsakademi og forskerholdet ledet af Zhao Suwen fra ShanghaiTech University, sammen afslørede mekanismerne for ligandgenkendelse, aktivering og G-proteinkoblingsspecificitet af CCKR'er.
Forskerne løste først tre krystalstrukturer af den menneskelige CCKAR i kompleks med to små molekyle antagonister (lintitript og devazepid) og en fuld agonist NN9056, samt fem kryo-elektronmikroskopi (cryo-EM) strukturer af CCK-8 aktiveret CCKAR i kompleks med tre G-proteiner (Gi, Gs, og Gq) og gastrinaktiveret CCKBR koblet til to G-proteiner (Gi og Gq). De belyste mekanismerne for CCKRs genkendelse af ligander, CCKRs aktivering, og G-protein promiskuitet af CCKAR, som alle giver grundlæggende information til lægemiddelopdagelse af CCKR'er.
Forskerne præsenterede derefter strukturerne af sulfateret CCK-8 bundet CCKAR i kompleks med Gq, Gs, og Gi heterotrimere ved globale opløsninger på 2,9 ångstrøm, 3,1 ångstrøm, og 3,2 ångstrøm, henholdsvis. De afslørede bindingsmåden for endogene peptid CCK-8, og fandt, at sulfo-tyrosin i CCK-8 var afgørende for høj affinitet af endogent peptid til CCKAR.
Konsekvent, forskerne fandt, at Gq-protein viste den mest potente koblingsaktivitet af CCKAR. Disse resultater understøttede Gq som den dominerende transducer af CCKAR og fremhævede vigtigheden af grænsefladeområdet i G-proteinkoblingsselektivitet.
I øvrigt, forskerne rapporterede tre krystalstrukturer af CCKAR bundet til små molekylære antagonister og en peptidagonist, samt to cryo-EM-strukturer af Gi- og Gq-koblede CCKBR-komplekser. De afslørede bindingsmåden for CCKR'er af både peptid- og småmolekyleligander, og identificerede afgørende roller i genkendelsen af CCKAR af devazepid og lintitript, giver således en skabelon til at designe lægemidler rettet mod CCKR'er.
Ved at kombinere de inaktive og aktive strukturer af CCKAR med den molekylære simuleringsanalyse, forskerne foreslog den trinvise aktiveringsproces af CCKAR.
Resultaterne af disse to undersøgelser gav den første indsigt i ligandgenkendelse og aktivering af de to CCK-receptorer og gav en ny mulighed for at designe lægemidler rettet mod CCKR'er.
 Varme artikler
Varme artikler
-
 Methylerede phenylarseniske metabolitter identificeret i kyllingeleverKosttilskud, der indeholder arsen, har været forbudt i EU siden 1999 og i Nordamerika siden 2013. I mange lande tilsættes de stadig til fjerkræfoder for at forhindre parasitinfektion og fremme vægtøgn
Methylerede phenylarseniske metabolitter identificeret i kyllingeleverKosttilskud, der indeholder arsen, har været forbudt i EU siden 1999 og i Nordamerika siden 2013. I mange lande tilsættes de stadig til fjerkræfoder for at forhindre parasitinfektion og fremme vægtøgn -
 Ny tilgang gør det lettere at finde nye lægemidlerBåndrepræsentation af strukturen af et enzym kendt som ATP-PRT fra TB-bakterier (blå), bundet til en allosterisk aktivator (pink). Kredit:Luiz Carvalho Forskere har skabt en ny metode til screen
Ny tilgang gør det lettere at finde nye lægemidlerBåndrepræsentation af strukturen af et enzym kendt som ATP-PRT fra TB-bakterier (blå), bundet til en allosterisk aktivator (pink). Kredit:Luiz Carvalho Forskere har skabt en ny metode til screen -
 Forskere producerer omkostningseffektive, miljøvenligt glasmaterialeKomplekse strukturer af transparent smeltet silica fremstillet via sprøjtestøbning af den nyudviklede Glassomer-komposit. Kredit:Glassomer GmbH Glas er allestedsnærværende i højteknologiske produk
Forskere producerer omkostningseffektive, miljøvenligt glasmaterialeKomplekse strukturer af transparent smeltet silica fremstillet via sprøjtestøbning af den nyudviklede Glassomer-komposit. Kredit:Glassomer GmbH Glas er allestedsnærværende i højteknologiske produk -
 Ny tilgang til katalyse reducerer kuldioxid til metanDenne særlige overflade af kobber og sølv er vigtig for at opnå rækken af kemiske reaktioner i systemet, teamet designede. Kredit:University of Delaware Et stigende antal forskere leder hurtigt
Ny tilgang til katalyse reducerer kuldioxid til metanDenne særlige overflade af kobber og sølv er vigtig for at opnå rækken af kemiske reaktioner i systemet, teamet designede. Kredit:University of Delaware Et stigende antal forskere leder hurtigt
- FN-chef advarer om, at havene er truet som aldrig før (Opdatering)
- Bezos sag afslører milliardærers sårbarhed over for hackere
- Kontroversen om den menneskelige hjerne skaber nye celler
- Geologer afslører nye spor om den største masseudryddelse nogensinde
- Drikkevand i de sydvestlige kriminalforsorger sætter indsattes sundhed i fare
- Nyt gennembrud i krigen mod antibiotikaresistens


