Hvorfor er vandmolekyler tiltrukket af hinanden?
* Polaritet: Vandmolekyler er polære, hvilket betyder, at de har en lidt positiv ende (brintatomer) og et lidt negativt afslutning (iltatom). Dette skyldes den ujævne deling af elektroner mellem ilt- og brintatomer i molekylet.
* Hydrogenbindinger: Det lidt positive hydrogenatom i et vandmolekyle tiltrækkes af det lidt negative iltatom i et andet vandmolekyle. Denne attraktion danner en svag binding kaldet en brintbinding.
* stærk attraktion: Mens individuelle brintbindinger er svage, skaber den kollektive virkning af mange brintbindinger en stærk samlet attraktion mellem vandmolekyler.
Denne attraktion er ansvarlig for mange af vandets unikke egenskaber, herunder:
* Højt kogepunkt: Vand har et højere kogepunkt end mange andre væsker på grund af de stærke intermolekylære kræfter på grund af brintbinding.
* Høj overfladespænding: Vandmolekyler ved overfladen oplever en stærkere attraktion til molekylerne under dem, hvilket skaber en højere overfladespænding.
* Godt opløsningsmiddel: Vands polaritet giver det mulighed for at opløse mange ioniske og polære stoffer.
I resumé tiltrækkes vandmolekyler af hinanden på grund af dannelsen af brintbindinger mellem de lidt positive brintatomer og de lidt negative iltatomer af tilstødende molekyler. Denne attraktion bidrager til Water's mange unikke og vigtige egenskaber.
Sidste artikelHvad er forskellen mellem mineral turpentinolie og parafin?
Næste artikelHvorfor skulle CL få elektronet?
 Varme artikler
Varme artikler
-
 Emballage lavet af bananplanter et alternativ til a-peelingKredit:CC0 Public Domain Biologisk nedbrydelige plastik poser lavet af bananplanter lyder lidt...bananer, men et par UNSW-forskere har fundet en måde at gøre det på, og det kunne løse to industria
Emballage lavet af bananplanter et alternativ til a-peelingKredit:CC0 Public Domain Biologisk nedbrydelige plastik poser lavet af bananplanter lyder lidt...bananer, men et par UNSW-forskere har fundet en måde at gøre det på, og det kunne løse to industria -
 Inosin kan være en potentiel vej til det første RNA og livets oprindelse på JordenEt sted i det fjendtlige miljø på den tidlige Jord, livet blev født. Kredit:Harvard University Vores forhistoriske jord, bombarderet med asteroider og lyn, fyldt med boblende geotermiske pools, vi
Inosin kan være en potentiel vej til det første RNA og livets oprindelse på JordenEt sted i det fjendtlige miljø på den tidlige Jord, livet blev født. Kredit:Harvard University Vores forhistoriske jord, bombarderet med asteroider og lyn, fyldt med boblende geotermiske pools, vi -
 Insekter i frysende områder har et protein, der fungerer som frostvæskeFrostvæskeproteiner er en unik klasse af proteiner, hvis virkemekanisme ikke er forstået. Dette kunstneriske indtryk viser brugen af sum-frekvensgenereringsspektroskopi til at bestemme proteinernes
Insekter i frysende områder har et protein, der fungerer som frostvæskeFrostvæskeproteiner er en unik klasse af proteiner, hvis virkemekanisme ikke er forstået. Dette kunstneriske indtryk viser brugen af sum-frekvensgenereringsspektroskopi til at bestemme proteinernes -
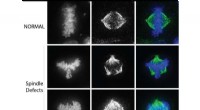 Afdækning af en ny mekanisme i celledelingI kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University Northwestern Medicine-forskere har afsløret den ro
Afdækning af en ny mekanisme i celledelingI kræftceller, defekter i den bipolære spindel fører til at trække kromosomer i flere retninger under celledeling. Kredit:Northwestern University Northwestern Medicine-forskere har afsløret den ro


