Har krystaller, der er udfældet fra en opløsning, unikke krystalformer?
Faktorer, der påvirker krystalform:
* Stof: Hver kemisk forbindelse har en specifik krystalstruktur, den foretrækker at danne. Dette styres af arrangementet af atomer og deres binding.
* Løsningsbetingelser:
* Temperatur: Højere temperaturer fører generelt til hurtigere vækst og mindre perfekte krystaller.
* Koncentration: Mættede opløsninger favoriserer krystalvækst, mens fortyndede opløsninger kan føre til mindre eller uregelmæssige krystaller.
* opløsningsmiddel: Det anvendte opløsningsmiddel kan påvirke krystalform.
* urenheder: Selv spormængder af andre stoffer kan væsentligt påvirke krystalmorfologien.
* nucleation: Hvordan og hvor de indledende krystalfrø form kan påvirke den samlede krystalform.
Unik vs. lignende:
* unik: I et ideelt scenarie kan en ren forbindelse under strengt kontrollerede forhold give en unik krystalform. Dette bruges ofte til at identificere stoffer i analytisk kemi.
* Lignende: Selv med det samme stof kan variationer i de ovennævnte forhold føre til små variationer i krystalstørrelse, form og vane (samlet udseende). Disse variationer kan stadig være genkendelige som tilhørende det samme krystalsystem (f.eks. Kubik, hexagonal osv.).
Eksempler:
* salt (NaCl): Former typisk kubiske krystaller, men forholdene kan føre til variationer i terningens udseende (flad, langstrakt osv.).
* kvarts (SiO2): Kendt for sine hexagonale krystaller, men igen kan små variationer i vækstmønstre føre til forskellige former.
Konklusion:
Krystaller udfældes fra en opløsning * kan * have unikke former, især hvis forholdene kontrolleres. Variationer i forhold er imidlertid almindelige, hvilket fører til mere subtile forskelle i krystaludseende snarere end helt unikke former.
Det er vigtigt at huske, at den grundlæggende krystalstruktur (hvordan atomer arrangeres) for en given forbindelse er normalt konsistent, men krystalens ydre form og udseende kan variere markant.
 Varme artikler
Varme artikler
-
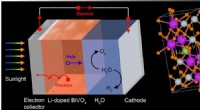 Kørevandsspaltning for at skabe kemiske brændstoffer(Venstre) Under sollys, vismutvanadat (BiVO4) - et lovende elektrodemateriale til vandspaltning - genererer elektron-hul-par (ladningsbærere) for at spalte vand til brint og oxygengas. Ved doping, el
Kørevandsspaltning for at skabe kemiske brændstoffer(Venstre) Under sollys, vismutvanadat (BiVO4) - et lovende elektrodemateriale til vandspaltning - genererer elektron-hul-par (ladningsbærere) for at spalte vand til brint og oxygengas. Ved doping, el -
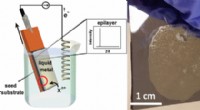 En billigere, grønnere måde at dyrke krystallinske halvlederfilm påKredit:ACS University of Michigan kemikere har udviklet en grønnere, billigere måde at lave enkeltkrystallinske halvlederfilm på, komponenter i hjertet af alle vores elektriske gadgets. Enkeltkry
En billigere, grønnere måde at dyrke krystallinske halvlederfilm påKredit:ACS University of Michigan kemikere har udviklet en grønnere, billigere måde at lave enkeltkrystallinske halvlederfilm på, komponenter i hjertet af alle vores elektriske gadgets. Enkeltkry -
 Grøn brint:Forskning for at øge effektivitetenHovedforfatteren til undersøgelsen, Aleksandr Bashkatov fra Institute of Fluid Dynamics. Kredit:HZDR / Stephan Floss Laboratorieeksperimenter og en parabolflyvningskampagne har gjort det muligt fo
Grøn brint:Forskning for at øge effektivitetenHovedforfatteren til undersøgelsen, Aleksandr Bashkatov fra Institute of Fluid Dynamics. Kredit:HZDR / Stephan Floss Laboratorieeksperimenter og en parabolflyvningskampagne har gjort det muligt fo -
 Undersøgelse fremhæver lovende galliumoxider for næste generation af strålingsdetektorerKredit:CC0 Public Domain Ny forskning fra North Carolina State University viser, at strålingsdetektorer, der gør brug af enkeltkrystal galliumoxid, gør det muligt at overvåge røntgenstråling i næs
Undersøgelse fremhæver lovende galliumoxider for næste generation af strålingsdetektorerKredit:CC0 Public Domain Ny forskning fra North Carolina State University viser, at strålingsdetektorer, der gør brug af enkeltkrystal galliumoxid, gør det muligt at overvåge røntgenstråling i næs
- EU lancerer Asien-strategi for at konkurrere med Kinas nye Silkevej
- Mumpreneurs:En voksende iværksætterkraft i det kinesiske samfund
- Amerikanske muslimer er i høj risiko for selvmord, knyttet til islamofobi
- Hvilket nummer er grundlæggende løsning?
- Hvad er typer atom i 6O2?
- Layered footballs:Første todimensionale organiske metal lavet af fullerener


