Hvad er størrelsen på brintsulfidmolekyle?
* obligationslængde: Afstanden mellem brint- og svovlatomer i brintsulfid (H₂S) er omkring 1,34 angstroms .
* molekylær diameter: Dette er lidt mere kompliceret at definere for et ikke-sfærisk molekyle. Du kan se på afstanden mellem de to hydrogenatomer, som er omtrent 2.04 angstroms , eller den maksimale afstand mellem to punkter på molekylet. Dette er dog bare tilnærmelser.
* van der Waals Radius: Dette henviser til den effektive radius af et molekyle til ikke-bundet interaktioner. Van der Waals Radius af svovl er cirka 1,85 Angstroms .
Derfor afhænger størrelsen på et hydrogensulfidmolekyle af hvilken dimension du er interesseret i. Det er omtrent 1,34 angstromer med hensyn til bindingslængde og omkring 2,04 angstromer på tværs.
Sidste artikelHvad er elektronkonfigurationen for fluoratom?
Næste artikelHvorfor er natriumbenzoatopløselig i vand?
 Varme artikler
Varme artikler
-
 Nye undersøgelser af gammel beton kunne lære os at gøre som romerneROMACONS borer ved en marine struktur i Portus Cosanus, Toscana, 2003. Boring sker med tilladelse fra Soprintendenza Archeologia per la Toscana. Kredit:J.P. Oleson Omkring år 79, Den romerske forf
Nye undersøgelser af gammel beton kunne lære os at gøre som romerneROMACONS borer ved en marine struktur i Portus Cosanus, Toscana, 2003. Boring sker med tilladelse fra Soprintendenza Archeologia per la Toscana. Kredit:J.P. Oleson Omkring år 79, Den romerske forf -
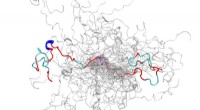 Supercomputing, neutroner forenes for at optrevle strukturer af iboende forstyrret proteinKonfigurationsensemblet (en samling af 3D-strukturer) af et iboende forstyrret protein, N-terminalen af c-Src kinase, som er et vigtigt signalprotein hos mennesker. Kredit:Oak Ridge National Laborat
Supercomputing, neutroner forenes for at optrevle strukturer af iboende forstyrret proteinKonfigurationsensemblet (en samling af 3D-strukturer) af et iboende forstyrret protein, N-terminalen af c-Src kinase, som er et vigtigt signalprotein hos mennesker. Kredit:Oak Ridge National Laborat -
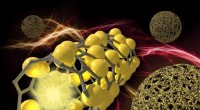 Et spring i at bruge silicium til batterianoderSiliciummikrosfærer har ekstraordinær mekanisk styrke på grund af tilsætning af kulnanorør, der får kuglerne til at ligne garnkugler. I denne repræsentation, billedet til venstre illustrerer et nærbil
Et spring i at bruge silicium til batterianoderSiliciummikrosfærer har ekstraordinær mekanisk styrke på grund af tilsætning af kulnanorør, der får kuglerne til at ligne garnkugler. I denne repræsentation, billedet til venstre illustrerer et nærbil -
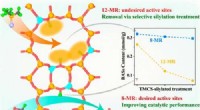 Ny strategi til at kontrollere fordelingen af syresteder i zeolitterGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05896 Zeolitter er en af de formselektive katalysatorer. Zeolitternes egenskaber, som kommer fra den strukturelle indeslutnin
Ny strategi til at kontrollere fordelingen af syresteder i zeolitterGrafisk abstrakt. Kredit:ACS Catalysis (2022). DOI:10.1021/acscatal.1c05896 Zeolitter er en af de formselektive katalysatorer. Zeolitternes egenskaber, som kommer fra den strukturelle indeslutnin
- En fjerde kop lig med hvor mange ounces?
- Smart software til smarte enheder
- Hvordan ændres den elektriske kraft mellem to ladede partikler, hvis en ladning øges med en faktor…
- Hvad sker der med densiteten, hvis et objekt afkøles?
- Hvorfor ser himlen sort ud fra måne, selvom solen skinner?
- MIT-holds plukke- og placeringssystem er på et andet niveau


