Hvad er elektronkonfigurationen for fluoratom?
1S² 2S² 2P⁵
Sådan forstår du det:
* 1S²: Det første energiniveau (n =1) har et sublevel, 'S' -udlysningen, der kan holde op til 2 elektroner. Så fluor har 2 elektroner i sin 1s orbital.
* 2s²: Det andet energiniveau (n =2) har også en 'S' Sublevel, der holder yderligere 2 elektroner.
* 2p⁵: Det andet energiniveau har et 'P' -subler, der kan holde op til 6 elektroner. Fluor har 5 elektroner i sine 2p orbitaler.
Fortæl mig, hvis du gerne vil have en mere detaljeret forklaring af elektronkonfigurationer!
Sidste artikelHvad er de fysiske egenskaber ved natriumhydrogencarbonat?
Næste artikelHvad er størrelsen på brintsulfidmolekyle?
 Varme artikler
Varme artikler
-
 Supermaterialer ud af mikrobølgeovnenKredit:CC0 Public Domain Ved hjælp af ikke-konventionelle metoder, Christina Birkel og hendes kolleger i Kemisk Institut ved TU Darmstadt producerer metallisk keramik og nye materialer til fremtid
Supermaterialer ud af mikrobølgeovnenKredit:CC0 Public Domain Ved hjælp af ikke-konventionelle metoder, Christina Birkel og hendes kolleger i Kemisk Institut ved TU Darmstadt producerer metallisk keramik og nye materialer til fremtid -
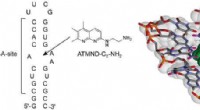 Den tætteste ikke-aminoglykosidligand til det bakterielle ribosomale RNA A-stedKemisk struktur af ATMND-C 2 -NH 2 og sekvensen af den bakterielle (Escherichia coli) A-sted-holdige RNA-model anvendt i denne undersøgelse. Det viser også den mulige struktur af komplekset mell
Den tætteste ikke-aminoglykosidligand til det bakterielle ribosomale RNA A-stedKemisk struktur af ATMND-C 2 -NH 2 og sekvensen af den bakterielle (Escherichia coli) A-sted-holdige RNA-model anvendt i denne undersøgelse. Det viser også den mulige struktur af komplekset mell -
 Affaldsplast, der omdannes til filtreringsmembranerBruno Pulido tester effektiviteten af holdets syntetiske membran. Kredit:KAUST I en verden, der synes at drukne i plastflasker, genanvendelse af dette affald til nyttige materialer ville bidrage
Affaldsplast, der omdannes til filtreringsmembranerBruno Pulido tester effektiviteten af holdets syntetiske membran. Kredit:KAUST I en verden, der synes at drukne i plastflasker, genanvendelse af dette affald til nyttige materialer ville bidrage -
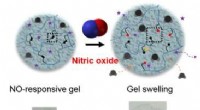 Forskere udvikler potentielt terapeutisk gel, som detekterer nitrogenoxid, absorberer overskydende v…IBS-forskere udviklede en hydrogel lavet af polymert akrylamid (blå spaghetti) forbundet med tværbindere (sort), som kan rumme lægemiddelmolekyler (lilla stjerner) inden for dets net (grå). I nærværel
Forskere udvikler potentielt terapeutisk gel, som detekterer nitrogenoxid, absorberer overskydende v…IBS-forskere udviklede en hydrogel lavet af polymert akrylamid (blå spaghetti) forbundet med tværbindere (sort), som kan rumme lægemiddelmolekyler (lilla stjerner) inden for dets net (grå). I nærværel
- Sandt eller falsk en objekt, der er flydende kraft og vægt, er ikke den samme ting?
- Hvordan adskiller elementer natrium og klor fra bordsaltformen?
- Hvem tog på Apollo 11-mission?
- Sådan kender du en transistor nummer
- Arkæologer har opdaget det tidligste menneskeskabte landskab på Jorden
- Ny rapport fremhæver virkningen af sundhedsuligheder i hele Europa


