Hvad sker der, når et kaliumatom og fluor kombineres for at danne par af ioner?
1. Forståelse af atomerne:
* kalium (k): Kalium har en valenselektron (elektron i dets yderste skal). Den ønsker at miste dette elektron for at opnå en stabil, fuld ydre skal som de ædle gasser.
* fluor (F): Fluor har syv valenselektroner. Den ønsker at få et elektron for at afslutte sin ydre skal og opnå stabilitet.
2. Overførslen:
* Elektronoverførsel: Kalium opgiver let sin enkle valenselektron til fluor. Denne overførsel er drevet af ønsket fra begge atomer om at opnå en stabil elektronkonfiguration.
* iondannelse:
* Kalium, efter at have mistet en elektron, har nu en mindre negativ ladning og bliver en positivt ladet ion (K+).
* Fluor, efter at have fået en elektron, har nu en ekstra negativ ladning og bliver en negativt ladet ion (F-).
3. Den ioniske binding:
* Elektrostatisk attraktion: De modsatte ladede ioner (K+ og F-) er stærkt tiltrukket af hinanden på grund af elektrostatiske kræfter. Denne attraktion er det, der danner den ioniske binding.
* ionisk forbindelse: Den resulterende forbindelse, kaliumfluorid (KF), holdes sammen af de stærke ioniske bindinger mellem de positivt ladede kaliumioner og de negativt ladede fluorioner.
Sammendrag:
Kombinationen af et kaliumatom og et fluoratom involverer en elektronoverførsel, hvilket resulterer i dannelsen af positivt ladede kaliumioner (K+) og negativt ladede fluorioner (F-). Disse ioner holdes derefter sammen af stærke elektrostatiske kræfter, der danner den ioniske sammensatte kaliumfluorid (KF).
 Varme artikler
Varme artikler
-
 Forskere finder skadelige kemikalier i husstøvKredit:CC0 Public Domain Siden 1970’erne har kemikalier kaldet bromerede flammehæmmere (BFRer) er blevet tilføjet til en lang række forbruger- og husholdningsprodukter, lige fra elektronik og madr
Forskere finder skadelige kemikalier i husstøvKredit:CC0 Public Domain Siden 1970’erne har kemikalier kaldet bromerede flammehæmmere (BFRer) er blevet tilføjet til en lang række forbruger- og husholdningsprodukter, lige fra elektronik og madr -
 Lyser vejen til forbedrede biomaterialerKredit:Sleiman Lab Forskere fra McGill University mener, at de har fundet en måde at forbedre udviklingen af biomaterialer, der kunne være medvirkende til lægemiddellevering, vævsregenerering, n
Lyser vejen til forbedrede biomaterialerKredit:Sleiman Lab Forskere fra McGill University mener, at de har fundet en måde at forbedre udviklingen af biomaterialer, der kunne være medvirkende til lægemiddellevering, vævsregenerering, n -
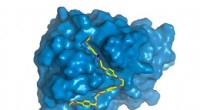 Forskning forbedrer enzym, der nedbryder plastikPETase er vist i blåt, med PET-kæde (gul) bundet til det aktive sted, hvor det vil blive forringet. Kredit:Rodrigo Leandro Silveira Siden det blev opdaget, enzymet kendt som PETase har vakt stor v
Forskning forbedrer enzym, der nedbryder plastikPETase er vist i blåt, med PET-kæde (gul) bundet til det aktive sted, hvor det vil blive forringet. Kredit:Rodrigo Leandro Silveira Siden det blev opdaget, enzymet kendt som PETase har vakt stor v -
 Oliefrøafgrøder affaldsprodukt giver forbindelser, der beskytter huden mod solenKredit:Oregon State University Meadowfoam, en indfødt Pacific Northwest-plante dyrket som en oliefrøafgrøde, er opstået som en potentiel ny kilde til beskyttelse mod solens skadelige virkninger på
Oliefrøafgrøder affaldsprodukt giver forbindelser, der beskytter huden mod solenKredit:Oregon State University Meadowfoam, en indfødt Pacific Northwest-plante dyrket som en oliefrøafgrøde, er opstået som en potentiel ny kilde til beskyttelse mod solens skadelige virkninger på
- Nye fund:Forskelle i partikler kan omforme undersøgelser af luftforurening
- Forskere skaber vej til at drive pacemaker med lys
- Forskning viser, at TSA kan have savnet tusindvis af skydevåben ved kontrolposter i 2016-2018
- En infektion, hvor DNA af en virus er indlejret i værtscelle og replikerer med kaldet hvad?
- Er vand bag en dæmningskinetisk energi?
- Spindende sorte huller kan deformeres under et eksternt og statisk gravitationsfelt


