Hvad er reaktionen af natriumhydrogenphosphat og vand?
Her er en sammenbrud af reaktionen:
* Hydrogenphosphation (HPO₄²⁻) fungerer som en svag base. Den accepterer en proton (H⁺) fra vand og danner dihydrogenphosphation (H₂po₄⁻) og hydroxidioner (OH⁻).
* Ligningen for hydrolysereaktionen er:
HPO₄²⁻ (aq) + H₂O (L) ⇌ H₂po₄⁻ (aq) + OH⁻ (aq)
* Tilstedeværelsen af hydroxidioner (OH⁻) i opløsningen gør det lidt grundlæggende.
Vigtige noter:
* Reaktionen er en ligevægtsreaktion, hvilket betyder, at den fortsætter i begge retninger.
* Omfanget af hydrolyse (og den resulterende pH) afhænger af koncentrationen af natriumhydrogenphosphat.
* Natriumhydrogenphosphat er en almindelig buffer, hvilket betyder, at det hjælper med at modstå ændringer i pH.
Sammenfattende resulterer reaktionen af natriumhydrogenphosphat og vand i en lidt grundlæggende opløsning på grund af hydrolyse af hydrogenphosphationen.
 Varme artikler
Varme artikler
-
 En hurtigere, billigere test påviser fødevarebåren toksinARS -kemiker Reuven Rasooly og biovidenskabstekniker Paula Undersøg fødevarebårne toksiner. Rasooly udviklede en test til påvisning af stafylokok -enterotoksiner i fødevarer. Kredit:Stephen Ausmus
En hurtigere, billigere test påviser fødevarebåren toksinARS -kemiker Reuven Rasooly og biovidenskabstekniker Paula Undersøg fødevarebårne toksiner. Rasooly udviklede en test til påvisning af stafylokok -enterotoksiner i fødevarer. Kredit:Stephen Ausmus -
 Svovlfjernende bakterier kan være nøglen til at lave fælles komponent i plastikForskere har opdaget, hvordan mikrober i vandlidende jorde producerer høje niveauer af ethylen, hvilket kan have en negativ indvirkning på landbrugsafgrøder og bioenergiråvarer som skiftegræs. Denne n
Svovlfjernende bakterier kan være nøglen til at lave fælles komponent i plastikForskere har opdaget, hvordan mikrober i vandlidende jorde producerer høje niveauer af ethylen, hvilket kan have en negativ indvirkning på landbrugsafgrøder og bioenergiråvarer som skiftegræs. Denne n -
 Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet
Team får indsigt i oxidlaget af rustfrit stålFra venstre, Lin Zhu, beamline videnskabsmand; Alexei Zakharov, MAXPEEM beamline manager; Axel Knutsson, Materialespecialist hos Alfa Laval; Oskar Darselius Berg, Alfa Laval. Kredit:Lunds Universitet -
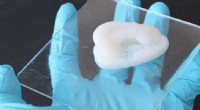 Udskrivning af komplekse cellulosebaserede objekterEn 3D-trykt ørebruskimitation lavet af cellulosekompositmaterialet. Kredit:Michael Hausmann / ETH Zürich / Empa Forskere fra ETH Zürich og de schweiziske føderale laboratorier for materialevidensk
Udskrivning af komplekse cellulosebaserede objekterEn 3D-trykt ørebruskimitation lavet af cellulosekompositmaterialet. Kredit:Michael Hausmann / ETH Zürich / Empa Forskere fra ETH Zürich og de schweiziske føderale laboratorier for materialevidensk
- Hvilken klippe har en mørkere farvebasalt eller granit?
- Hvordan påvirker saltholdigheden opløseligheden af ilt i vand?
- Falder ting med samme hastighed?
- Fremstilling af bedre batterier via TEM-observation i realtid
- Biochar hjælper med at holde vand, sparer penge
- Boeing 737 MAX flyvekontrolsystem nøglefaktor i Lion Air -styrt


