Hvad er forholdet mellem brintbinding og samhørighed?
* Hydrogenbinding: Hydrogenbindinger er relativt svage attraktioner mellem et hydrogenatom kovalent knyttet til et stærkt elektronegativt atom (som ilt i vand) og et elektronpar i det tilstødende molekyle. Dette skaber en "klistret" interaktion mellem vandmolekyler.
* samhørighed: Samhørighed henviser til tiltrækningen mellem molekyler af det samme stof. I vand fører de stærke brintbindinger mellem vandmolekyler til en høj grad af samhørighed. Dette betyder, at vandmolekyler "klæber" sammen.
Her er, hvordan dette forhold spiller ud:
* Høj overfladespænding: Den stærke samhørighed af vandmolekyler skaber en høj overfladespænding. Dette er grunden til, at vand danner dråber, og hvorfor insekter kan gå på vandet.
* kapillær handling: Samhørighed bidrager også til kapillær handling. Vandmolekyler tiltrækkes af hinanden og til væggene i smalle rør, hvilket får vand til at stige mod tyngdekraften i rør eller porøse materialer.
* opløselighed af polære molekyler: Polariteten af vandmolekyler på grund af hydrogenbinding giver den mulighed for at opløse andre polære molekyler. Tiltrækningen mellem vandmolekyler og polære molekyler som sukker og salte er afgørende for mange biologiske processer.
Kortfattet: Hydrogenbindinger mellem vandmolekyler skaber stærk samhørighed, hvilket fører til flere vigtige egenskaber ved vand, herunder høj overfladespænding, kapillærvirkning og evnen til at opløse polære molekyler.
Sidste artikelHvorfor er atomer af brom så reaktive?
Næste artikelElektronladning af jern III -sulfat?
 Varme artikler
Varme artikler
-
 Naturgasanlæg uden CO2-udledningCLC-facilitet - med Robert Pachler og Stephan Piesenberge Hvordan kan vi forbrænde naturgas uden at frigive CO2 til luften? Denne bedrift opnås ved hjælp af en speciel forbrændingsmetode, som TU W
Naturgasanlæg uden CO2-udledningCLC-facilitet - med Robert Pachler og Stephan Piesenberge Hvordan kan vi forbrænde naturgas uden at frigive CO2 til luften? Denne bedrift opnås ved hjælp af en speciel forbrændingsmetode, som TU W -
 Bayer taber endnu en appel af Roundup-kræftdommenRoundup er genstand for tusindvis af retssager i USA. Den tyske medicinal- og kemikaliegigant Bayer tabte endnu en appel mod en dom, der fandt, at dens Roundup ukrudtsmiddel forårsager kræft. det
Bayer taber endnu en appel af Roundup-kræftdommenRoundup er genstand for tusindvis af retssager i USA. Den tyske medicinal- og kemikaliegigant Bayer tabte endnu en appel mod en dom, der fandt, at dens Roundup ukrudtsmiddel forårsager kræft. det -
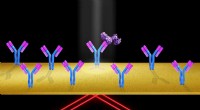 Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteinerNår proteinmolekyler (lilla) binder sig til immobiliserede receptormolekyler, (som de Y-formede antistoffer, der er fastgjort til objektglassets overflade), brydningsindekset ved guldoverfladen ændres
Teknikken tillader praktisk, præcis optisk billeddannelse af individuelle proteinerNår proteinmolekyler (lilla) binder sig til immobiliserede receptormolekyler, (som de Y-formede antistoffer, der er fastgjort til objektglassets overflade), brydningsindekset ved guldoverfladen ændres -
 Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy
Første gangs direkte bevis på kemiske reaktioner i partiklerMed denne enhed, partikler kan analyseres bedre end nogensinde før. Kredit:Paul Scherrer Institute/Mahir Dzambegovic Forskere ved Paul Scherrer Institute PSI har udviklet en ny metode til at analy
- Hvilken del af en celle tillader stoffer at passere gennem den?
- First American Financial afslørede data i millioner af realkreditdokumenter, siger rapporten
- Zombiemyrehjerner efterladt intakte af svampeparasit
- Forskere studerer tilstedeværelsen af fluorholdige kemikalier i brandmandstøj
- Hvilke planeter har både måner og ringe?
- NASA sporer en svagere tropisk storm Fung-Wong


