Hvorfor er atomer af brom så reaktive?
* Elektronkonfiguration: Bromin har 7 valenselektroner (elektroner i den yderste skal). Den ønsker at have en fuld ydre skal af 8 elektroner til stabilitet, svarende til de ædle gasser. For at opnå dette får brom let en elektron til dannelse af en bromidion (BR-).
* Elektronegativitet: Bromin har en relativt høj elektronegativitet, hvilket betyder, at den stærkt tiltrækker elektroner. Dette gør det sandsynligt, at det trækker elektroner væk fra andre atomer i en kemisk reaktion.
* lille atomradius: Bromin har en mindre atomradius sammenlignet med større halogener som jod. Dette betyder, at elektronerne i dens ydre skal holdes tættere af kernen og tiltrækkes lettere af andre atomer.
Disse faktorer bidrager til Bromins høje reaktivitet. Det deltager let i reaktioner for at få en elektron og opnå en stabil oktetkonfiguration.
 Varme artikler
Varme artikler
-
 Konkylieskaller spreder hemmeligheden bag deres sejhedTeamet 3-D printede kompositmaterialer med præcist kontrollerede strukturer, og udførte test i et faldtårn, der gjorde det muligt for dem at observere præcis, hvordan revner opstod og spredte sig - el
Konkylieskaller spreder hemmeligheden bag deres sejhedTeamet 3-D printede kompositmaterialer med præcist kontrollerede strukturer, og udførte test i et faldtårn, der gjorde det muligt for dem at observere præcis, hvordan revner opstod og spredte sig - el -
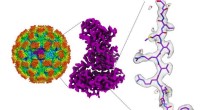 Norovirusstrukturer kan hjælpe med at udvikle behandlinger mod madforgiftningZoomer ind på norovirusstrukturen ved nær atomare detaljer Kredit:Joshua-Tor lab/CSHL 2019 Norovirus er en førende årsag til fødevarebårne sygdomsudbrud, tegner sig for 58 % af alle udbrud og forå
Norovirusstrukturer kan hjælpe med at udvikle behandlinger mod madforgiftningZoomer ind på norovirusstrukturen ved nær atomare detaljer Kredit:Joshua-Tor lab/CSHL 2019 Norovirus er en førende årsag til fødevarebårne sygdomsudbrud, tegner sig for 58 % af alle udbrud og forå -
 Nyt membranvandbehandlingssystem til reducering af giftigt affald og omkostninger til bortskaffelse …Dr Adil Dhalla (venstre), Administrerende direktør for START Center, holder den nye tri-bore hulfibermembran, med Dr Antony Prince (til højre), Grundlægger af Memsift Innovations, holder det færdige m
Nyt membranvandbehandlingssystem til reducering af giftigt affald og omkostninger til bortskaffelse …Dr Adil Dhalla (venstre), Administrerende direktør for START Center, holder den nye tri-bore hulfibermembran, med Dr Antony Prince (til højre), Grundlægger af Memsift Innovations, holder det færdige m -
 Løbende honning, lodnet spinat og skinnende æbler:Overraskende fakta om din madKredit:Dean Drobot/Shutterstock At bruge meget mere tid i dit hus behøver ikke at gøre dig mindre nysgerrig på verden omkring dig. Bare kig ind i dine køkkenskabe, og der er et væld af kemi, der b
Løbende honning, lodnet spinat og skinnende æbler:Overraskende fakta om din madKredit:Dean Drobot/Shutterstock At bruge meget mere tid i dit hus behøver ikke at gøre dig mindre nysgerrig på verden omkring dig. Bare kig ind i dine køkkenskabe, og der er et væld af kemi, der b
- Er eksponentiel notation den samme som videnskabelig notation?
- Hvad er kobberoxidordligningen?
- Når stjerner kolliderer, hvor stor en eksplosion er det?
- Hvad kaldes temperaturen, hvor den anden virale koefficient for en reel gas nul?
- Hvor lang tid tager det en fremragende jernkerne at kollapse?
- Hvornår blev den første videnskabelige observation lavet?


