Hvad er oxidationstilstanden for et element?
Her er en sammenbrud:
* Elektronegativitet: Dette er et atoms evne til at tiltrække elektroner mod sig selv i en kemisk binding.
* Kemiske bindinger: Atomer deler eller overfører elektroner for at danne bindinger.
* Oxidationstilstand: Det tildeles et atom i et molekyle eller ion.
* En positiv oxidationstilstand betyder, at atomet har mistet elektroner (det er blevet oxideret).
* En negativ oxidationstilstand betyder, at atomet har vundet elektroner (det er reduceret).
* En oxidationstilstand af nul betyder, at atomet ikke har mistet eller opnået elektroner.
regler for bestemmelse af oxidationstilstande:
1. Gratis elementer: Oxidationstilstanden for et atom i sin elementære form er altid 0. (f.eks. Na, O2, Cl2)
2. Monatomiske ioner: Oxidationstilstanden er lig med ionens ladning. (f.eks. Na + =+1, O2- =-2)
3. fluor: Fluor har altid en oxidationstilstand på -1.
4. ilt: Oxygen har normalt en oxidationstilstand på -2, undtagen i peroxider (som H2O2), hvor det er -1, og i forbindelser med fluor, hvor det er positivt.
5. brint: Hydrogen har normalt en oxidationstilstand på +1, undtagen i metalhydrider (som NAH), hvor det er -1.
6. Summen af oxidationstilstande i et neutralt molekyle er nul.
7. Summen af oxidationstilstande i en polyatomisk ion svarer til ladningen af ionen.
Eksempel:
Lad os tage vand (H2O):
* Oxygen (O) har en oxidationstilstand på -2 (regel 4).
* Hydrogen (H) har en oxidationstilstand på +1 (regel 5).
* Da der er to hydrogenatomer, er den samlede oxidationstilstand for brint +2.
* Summen af oxidationstilstandene (+2 - 2) er lig med nul, hvilket bekræfter, at molekylet er neutral.
Betydningen af oxidationstilstande:
* Forudsigelse af kemiske reaktioner: At kende oxidationstilstandene for elementer hjælper med at forudsige, om en reaktion sandsynligvis vil forekomme, og hvilke produkter der kan dannes.
* afbalancering af kemiske ligninger: Oxidationstilstande hjælper med at afbalancere redoxreaktioner (reaktioner, der involverer elektronoverførsel).
* Forståelse af kemisk binding: Oxidationstilstande giver indsigt i arten af kemiske bindinger og fordelingen af elektroner i molekyler.
Fortæl mig, hvis du gerne vil arbejde gennem flere eksempler!
 Varme artikler
Varme artikler
-
 Solceller med nye grænsefladerKredit:CC0 Public Domain Forskere fra NUST MISIS (Rusland) og Tor Vergata-universitetet i Rom fandt ud af, at en mikroskopisk mængde todimensionalt titankarbid kaldet MXene forbedrer væsentligt op
Solceller med nye grænsefladerKredit:CC0 Public Domain Forskere fra NUST MISIS (Rusland) og Tor Vergata-universitetet i Rom fandt ud af, at en mikroskopisk mængde todimensionalt titankarbid kaldet MXene forbedrer væsentligt op -
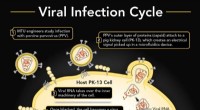 Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir
Microfluidics hjælper ingeniører med at se virusinfektion i realtid1. Porcint parvovirus (PPV) inficerer en svinenyrecelle (PK-13). 2. PPV binder sig til PK-13 ved hjælp af dets ydre lag af proteiner (kapsid), som kan detekteres i en mikrofluidikanordning. 3. Det vir -
 Robust fast katalysator giver høje udbytter af estere ved kontinuerlig strømningFigur 1:At gå tilbage til gymnasiekemi gjorde det muligt for RIKEN-kemikere at udvikle en katalysator, der kan producere estere ved høje udbytter i en kontinuerlig flow-proces. Kredit:Andrew Lambert P
Robust fast katalysator giver høje udbytter af estere ved kontinuerlig strømningFigur 1:At gå tilbage til gymnasiekemi gjorde det muligt for RIKEN-kemikere at udvikle en katalysator, der kan producere estere ved høje udbytter i en kontinuerlig flow-proces. Kredit:Andrew Lambert P -
 Opdagelse rejser muligheden for at behandle neurologiske lidelserKredit:University of Dundee Opdagelsen af en ny klasse af enzymer i human biologi af forskere ved University of Dundee har åbnet et nyt forskningsområde, der kan gavne patienter, der lider af en
Opdagelse rejser muligheden for at behandle neurologiske lidelserKredit:University of Dundee Opdagelsen af en ny klasse af enzymer i human biologi af forskere ved University of Dundee har åbnet et nyt forskningsområde, der kan gavne patienter, der lider af en
- Hvorfor er bariumsulfat godt skjold mod gammastråler?
- Hvad er bølgelængden af et 300 MHz signal i frit rum?
- Hvad betyder udtrykket energi, da det henviser til økosystemer?
- Forskellen mellem isotoper af samme element
- Hvilke processer har resulteret i, at den største mængde termisk energi overføres til kernen?
- Forskning har til formål at styrke retfærdighedsoplevelsen for ofre for seksuel vold


