Hvorfor kombineres sølvnitrat først med chloridioner i vand og ikke kaliumdichromat?
Her er hvorfor dette sker:
* opløselighedsregler: Generelt er chlorid -salte opløselige, bortset fra dem, der indeholder sølv (AG⁺), bly (PB²⁺) og kviksølv (I) (HG₂²⁺). Dette betyder, at sølvchlorid danner et fast bundfald, når sølvioner (Ag⁺) fra sølvnitratmøder chloridioner (CL⁻) i opløsning.
* reaktionsbalance: Reaktionen mellem sølvnitrat og chloridioner danner et bundfald, fordi ligevægten stærkt favoriserer dannelsen af fast sølvchlorid. Dette skyldes den stærke tiltrækning mellem sølv- og chloridioner, hvilket fører til dannelsen af en stabil, uopløselig gitterstruktur.
* kaliumdichromatopløselighed: Kaliumdichromat er på den anden side en opløselig forbindelse. Det adskiller sig i kaliumioner (K⁺) og dichromationer (cr₂o₇²⁻) i vand, der forbliver i opløsning.
Kortfattet: Sølvnitrat reagerer fortrinsvis med chloridioner, fordi dannelsen af det uopløselige sølvchloridudfældning driver reaktionen på færdiggørelse. Kaliumdichromat, der er opløselig, danner ikke et bundfald og konkurrerer derfor ikke med dannelsen af sølvchlorid.
Sidste artikelHar faste stoffer mere masse end væsker og gasser?
Næste artikelEr sølvchromatopløselig i vand?
 Varme artikler
Varme artikler
-
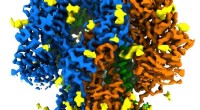 Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirusDette billede viser den detaljerede struktur af en spids fra en coronavirus, der forårsager forkølelsessymptomer - en mildere slægtning til den virus, der forårsager COVID-19. Pigge binder sig til rec
Forskere får det mest realistiske billede endnu af en proteinstruktur med spikes af coronavirusDette billede viser den detaljerede struktur af en spids fra en coronavirus, der forårsager forkølelsessymptomer - en mildere slægtning til den virus, der forårsager COVID-19. Pigge binder sig til rec -
 Team udvikler nye måder at skabe og levere medicin til en bred vifte af immunmedicinske neuropatierKredit:Liverpool School of Tropical Medicine Forskere ved LSTM ser på nye måder at skabe og levere medicin til en bred vifte af immunmedicinerede neuropatier, ved at udvikle nye syntetiske version
Team udvikler nye måder at skabe og levere medicin til en bred vifte af immunmedicinske neuropatierKredit:Liverpool School of Tropical Medicine Forskere ved LSTM ser på nye måder at skabe og levere medicin til en bred vifte af immunmedicinerede neuropatier, ved at udvikle nye syntetiske version -
 Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi
Gør ammoniak grønnereGrafisk illustration, der viser protoneret vand, der reagerer med nitrogenmolekyler for at danne ammoniak ved en plasma-væske-grænseflade. Kredit:Case Western Reserve University Ammoniak, en forbi -
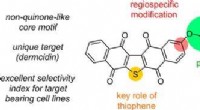 Havvandsbakterier giver fører til bekæmpelse af melanomKredit:American Chemical Society Malignt melanom kan være en særlig farlig form for kræft, og flere terapeutiske muligheder er nødvendige. Nu, forskere rapporterer i ACS Medicinal Chemistry Lette
Havvandsbakterier giver fører til bekæmpelse af melanomKredit:American Chemical Society Malignt melanom kan være en særlig farlig form for kræft, og flere terapeutiske muligheder er nødvendige. Nu, forskere rapporterer i ACS Medicinal Chemistry Lette
- Lille partikel, der flyder rundt om et kredsløb?
- Er nichromtråd en god leder af varme og elektricitet?
- Hvad er forskellen mellem ioniske krystaller og metallisk binding?
- Hvis Canada mener alvor med at konfrontere systemisk racisme, vi skal afskaffe fængsler
- Hvilke udfordringer står geologer over for?
- Gennem skueglasset:Optrævler, hvordan ioner bevæger sig i fosfatglas


