Hvorfor er natriumchloridopløselig i vand, men ikke alkohol?
opløselighed:et spørgsmål om tiltrækning
Opløselighed handler om et stofs evne (opløsningen) til at opløses i et andet (opløsningsmidlet). Den nøglefaktor, der bestemmer opløselighed, er den relative styrke af attraktionerne mellem:
* opløsningsopløsningsattraktioner: Kræfterne, der holder de opløste molekyler (eller ioner, i tilfælde af NaCl) sammen.
* opløsningsmiddel-opløsningsmiddelattraktioner: Kræfterne, der holder opløsningsmiddelmolekylerne sammen.
* opløsningsmiddel attraktioner: De kræfter, der udvikler sig mellem de opløste og opløsningsmiddelmolekyler.
vand:et polært opløsningsmiddel
* Vand (H₂O) er en polar molekyle. Dette betyder, at det har en lidt positiv ende (hydrogenatomerne) og en lidt negativ ende (iltatomet). Denne polaritet giver vandmolekyler mulighed for at danne stærke brintbindinger med hinanden.
* Når NaCl opløses i vand, positive natriumioner (NA⁺) tiltrækkes af den negative ende af vandmolekylerne, mens negative chloridioner (cl⁻) tiltrækkes af den positive ende af vandmolekylerne.
* Disse stærke ion-dipol-interaktioner Overvinde de ioniske bindinger, der holder natrium- og chloridioner sammen i krystalgitteret, hvilket gør det muligt for saltet at opløses.
alkohol:et mindre polært opløsningsmiddel
* De fleste alkoholer, som ethanol (C₂H₅OH), er mindre polære end vand. De har et svagere dipolmoment og danner svagere brintbindinger med hinanden.
* Alkoholer Stol primært på svagere London -spredningskræfter at tiltrække hinanden.
* Mens alkoholer kan danne nogle hydrogenbindinger Med ioner er disse interaktioner ikke stærke nok til at overvinde de stærke ioniske attraktioner inden for NaCl -krystalgitteret.
Den nederste linje
Kort sagt, vandets stærke polaritet og evne til at danne stærke ion-dipol-interaktioner med ionerne i NaCl giver det mulighed for at opløse saltet. Alkoholer, der er mindre polære, kan ikke danne stærke nok interaktioner til at forstyrre de ioniske bindinger inden for NaCl -strukturen og således forhindre opløsning.
 Varme artikler
Varme artikler
-
 Lysere fremtiden for halvlederbaserede fotokatalytiske processerAtom transfer radikal addition (ATRA) reaktion mellem diethylbrommalonat (DEBM) og 5-hexen-1-ol som en reaktionsmodel. Kredit:Dr. Paola Riente Et samarbejde mellem Pericàs-gruppen med Prof. Timoth
Lysere fremtiden for halvlederbaserede fotokatalytiske processerAtom transfer radikal addition (ATRA) reaktion mellem diethylbrommalonat (DEBM) og 5-hexen-1-ol som en reaktionsmodel. Kredit:Dr. Paola Riente Et samarbejde mellem Pericàs-gruppen med Prof. Timoth -
 Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også
Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også -
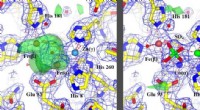 Ny røntgenmetode har dybtgående konsekvenser for udviklingen af livreddende lægemidlerDen nye metode, korrigere de forkert identificerede metaller, tilladt genfortolkning af uidentificerede funktioner, fremhævet med grønt, (billede til venstre) for at identificere, hvordan proteinet vi
Ny røntgenmetode har dybtgående konsekvenser for udviklingen af livreddende lægemidlerDen nye metode, korrigere de forkert identificerede metaller, tilladt genfortolkning af uidentificerede funktioner, fremhævet med grønt, (billede til venstre) for at identificere, hvordan proteinet vi -
 Hvordan muslinger laver en kraftig undervandslimMuslingernes skæg (som kogene fjerner, før de tilberedes) består af byssaltråde og bruges til at hjælpe med at holde muslingerne bundet på plads. For enden af hver tråd er en skiveformet plak, der f
Hvordan muslinger laver en kraftig undervandslimMuslingernes skæg (som kogene fjerner, før de tilberedes) består af byssaltråde og bruges til at hjælpe med at holde muslingerne bundet på plads. For enden af hver tråd er en skiveformet plak, der f
- Hvordan ser en konstellation ud?
- Nanopartikler til sundt væv
- Hvilken overfører bevægelse generatoren i vindenergi?
- Laboratorieforsøg viser, at halvleder nanotråde kan tunes over brede energiområder
- Forskere afslører, hvorfor pindsvin mejer ned Californiens tangskove
- Hvor mange dobbeltbindinger er der i C2H4?


