Hvad er oxidation og forklare denne proces?
Oxidation:Processen med at miste elektroner
Oxidation er en kemisk proces, der involverer tab af elektroner ved et molekyle, atom eller ion. Det er halvdelen af en redoxreaktion, en proces, hvor elektroner overføres fra en art til en anden.
Her er en sammenbrud af processen:
1. Elektrontab:
Når et stof oxideres, mister det en eller flere elektroner. Dette tab af negativt ladede elektroner resulterer i en stigning i oxidationstilstanden af atom, molekyle eller ion.
2. Redox -reaktioner:
Oxidation forekommer altid samtidig med reduktion , hvor et andet stof får de elektroner, der er mistet af de oxiderede arter. Denne koblede proces kaldes en redox -reaktion .
3. Identificering af oxidation:
Du kan identificere oxidation ved at observere:
* en stigning i stoffets oxidationstilstand. Dette involverer tab af elektroner og et mere positivt oxidationsnummer.
* Tilsætning af iltatomer til et molekyle.
* Fjernelse af brintatomer fra et molekyle.
Eksempler:
* Rusting af jern: Jern (Fe) mister elektroner til ilt (O2) og danner jernoxid (Rust, Fe2O3). Jern oxideres, og ilt reduceres.
* forbrænding: Når brændstoffer som træ eller metanforbrænding mister de elektroner til ilt og danner kuldioxid (CO2) og vand (H2O). Dette er en oxidationsproces.
* respiration: I vores kroppe oxideres glukose til at producere energi og frigiver elektroner, der bruges til at drive forskellige cellulære processer.
nøglepunkter at huske:
* Oxidation involverer tab af elektroner.
* Oxidation forekommer altid med reduktion.
* Oxidation kan identificeres ved en stigning i oxidationstilstand, tilsætning af ilt eller fjernelse af brint.
At forstå oxidation er afgørende inden for forskellige videnskabelige områder, herunder kemi, biologi og miljøvidenskab. Det forklarer en lang række kemiske reaktioner og processer, der forekommer i naturen og i vores daglige liv.
 Varme artikler
Varme artikler
-
 Plane og buede pyrrol-fusionerede azacoronerπ-Udvidet azacoronen med en Janus dobbeltkonkav struktur Credit:Graduate School of Science and Engineering, Ehime Universitet Nylige undersøgelser af syntetiske tilgange til polycykliske aromatisk
Plane og buede pyrrol-fusionerede azacoronerπ-Udvidet azacoronen med en Janus dobbeltkonkav struktur Credit:Graduate School of Science and Engineering, Ehime Universitet Nylige undersøgelser af syntetiske tilgange til polycykliske aromatisk -
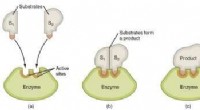 Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi
Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraftGrafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemi -
 Sådan hjælper du miljøet:Gør madolie til vedvarende brændstofferZhiyao (Yao) Lu leder en USC Dornsife startup, der har udviklet en teknologi designet til at gøre vegetabilsk olie til vedvarende brændstoffer og bionedbrydeligt plast. Kredit:Rhonda Hillberry Dri
Sådan hjælper du miljøet:Gør madolie til vedvarende brændstofferZhiyao (Yao) Lu leder en USC Dornsife startup, der har udviklet en teknologi designet til at gøre vegetabilsk olie til vedvarende brændstoffer og bionedbrydeligt plast. Kredit:Rhonda Hillberry Dri -
 Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen
Computermodellering af WNK-kinasehæmmere kunne tilbyde nye værktøjer til at forstå hypertensionKredit:North Carolina State University Forskere fra North Carolina State University har modelleret og analyseret bindingsmåderne for 210 molekyler, der tidligere er rapporteret at hæmme funktionen
- Hvilken er ikke en konventionel energikilde?
- Kan standardiseret test fange læringspotentiale?
- Hvordan klimaændringer reducerede strømmen af Colorado-floden
- NASAs flyvende observatorium udvider nye grænser i solsystemet og videre
- Hvad kaldes en reaktion mellem syre og base?
- Fremgangsmåde til visualisering af defekter i krystalfaste stoffer forstærket af kunstig intellige…


