Hvis der produceres 40 gram natriumhydroxid og 3 brintgas, når 27 metal forbruges, hvor mange flydende vand der må være tilsat?
Sådan kan vi nedbryde problemet og løse det:
1. Identificer reaktionen:
Reaktionen er:
Metal + vand → natriumhydroxid + brintgas
2. Skriv en afbalanceret kemisk ligning:
For at gøre dette er vi nødt til at kende det involverede specifikke metal. Lad os antage, at metallet er natrium (NA). Den afbalancerede ligning ville være:
2 Na + 2 H₂O → 2 NaOH + H₂
3. Konverter gram til mol:
* natriumhydroxid (NaOH): 40 gram Naoh.
- Den molære masse af NaOH er ca. 40 g/mol.
- Derfor er 40 gram NaOH lig med 1 mol.
* brintgas (H₂): 3 gram H₂
- Den molære masse af H₂ er ca. 2 g/mol.
- Derfor er 3 gram H₂ lig med 1,5 mol.
4. Brug molforholdet fra den afbalancerede ligning:
Den afbalancerede ligning viser, at der for hver 2. mol af NaOH produceret, 2 mol H₂O forbruges.
Da vi har 1 mol NaOH, kan vi oprette en andel:
2 mol NaOH / 2 mol H₂O =1 mol NaOH / X mol H₂O
Løsning for X finder vi ud af, at x =1 mol H₂O
5. Konverter mol til gram:
Den molære masse af H₂O er ca. 18 g/mol. Derfor er 1 mol H₂O lig med 18 gram.
Svar: 18 gram flydende vand skal være tilsat.
Vigtig note: Denne beregning antager, at metallet er natrium (NA). Hvis det er et andet metal, ændres den afbalancerede ligning og molforhold, og det endelige svar vil være anderledes.
 Varme artikler
Varme artikler
-
 blidere, sikrere hårfarve baseret på syntetisk melaninEn mildere hårfarve baseret på syntetisk melanin kan producere en række farver, fra mørkebrun til rødguld. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00068 Med coron
blidere, sikrere hårfarve baseret på syntetisk melaninEn mildere hårfarve baseret på syntetisk melanin kan producere en række farver, fra mørkebrun til rødguld. Kredit:Tilpasset fra ACS Central Science 2020, DOI:10.1021/acscentsci.0c00068 Med coron -
 Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm -
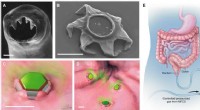 Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførselFormskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at t
Gastrointestinal-resident, formskiftende mikrodele til forlænget lægemiddeltilførselFormskiftende behandlere som selvlåsende medicinleveringsenheder. (A) Scanning elektronmikroskopi (SEM) billede af ventrikeltænderne på hookworm A. duodenale. Ormen bruger disse skarpe tænder til at t -
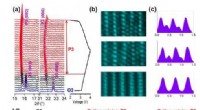 Kationblanding inducerer højeffektiv natriumlagring til lagdelte katoderStrukturel udvikling af NNCT-elektrode under den første cyklus. In-situ XRD-mønstre indsamlet for NNCT-elektrode cyklet i spændingsområdet 2,0-4,0 V (a); STEM-billeder af det uberørte (nederst), fuldt
Kationblanding inducerer højeffektiv natriumlagring til lagdelte katoderStrukturel udvikling af NNCT-elektrode under den første cyklus. In-situ XRD-mønstre indsamlet for NNCT-elektrode cyklet i spændingsområdet 2,0-4,0 V (a); STEM-billeder af det uberørte (nederst), fuldt
- Hvor ellers i chloroplaster translokerer kemiosmosis protoner fra?
- Kviksølvkoncentrationer i Yukon -flodfisk kunne overgå EPA -kriteriet inden 2050
- Probe skinner lys på overaktive immunceller for at hjælpe med at opdage, behandle visse kræftform…
- Dyr i Savanna Grassland
- Hvorfor fryser saltvand under 0 celsius?
- Ny teknologi udvinder potentiale for at identificere kvalitetsgrafen billigere og hurtigere


