Hvordan øger LE -princippet udbyttet af kemiske reaktioner?
le Chateliers princip:
* Hvis der anvendes en ændring af betingelsen på et system i ligevægt, skifter systemet i en retning, der lindrer stresset.
hvordan man anvender det til højere udbytter:
1. Temperatur:
* eksotermiske reaktioner: Sænkning af temperaturen favoriserer den fremadrettede reaktion (produktdannelse), når systemet forsøger at generere mere varme.
* endotermiske reaktioner: Forøgelse af temperaturen favoriserer den fremadrettede reaktion (produktdannelse), når systemet forsøger at absorbere mere varme.
2. tryk:
* reaktioner med forskellige mol gas: Stigende tryk favoriserer siden med færre mol gas, da systemet forsøger at reducere trykket.
* Eksempel: Hvis den fremadrettede reaktion har 2 mol gas, og det modsatte har 3 mol, favoriserer stigende tryk den fremadgående reaktion.
3. Koncentration:
* stigende reaktantkoncentration: Skiftning af ligevægten for at favorisere den fremadgående reaktion (mere produkt).
* Fjernelse af produkter: Fjernelse af produkter, når de dannes, skifter også ligevægten mod produktdannelse.
Vigtige overvejelser:
* ligevægt vs. komplet reaktion: Le Chateliers princip påvirker kun ligevægtspositionen, ikke omfanget af reaktionen. Nogle reaktioner, selv i ligevægt, kan muligvis kun have en lille mængde produkt dannet.
* reaktionshastighed: Mens skiftende ligevægt kan øge produktudbyttet, kan det muligvis ikke nødvendigvis fremskynde reaktionen. Du har muligvis stadig brug for en katalysator for at fremskynde reaktionsprocessen.
Kortfattet:
Le Chateliers princip giver værdifuld indsigt i, hvordan man manipulerer reaktionsbetingelser for at favorisere produktdannelse. Ved omhyggeligt at justere temperatur, tryk og reaktant/produktkoncentrationer kan du øge udbyttet af en kemisk reaktion. Det er dog vigtigt at forstå de specifikke betingelser for reaktionen og overveje dens ligevægt og kinetik for at opnå det ønskede resultat.
 Varme artikler
Varme artikler
-
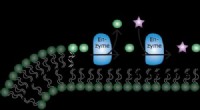 Archaeal enzym, der producerer membranlipider, er spektakulært promiskuøstIllustrationen viser produktionen af forskellige cardiolipiner og fosfolipider ved inkorporering af miljøforbindelser som lipidhovedgruppe. Kredit:Marten Exterkate, Universitetet i Groningen Cel
Archaeal enzym, der producerer membranlipider, er spektakulært promiskuøstIllustrationen viser produktionen af forskellige cardiolipiner og fosfolipider ved inkorporering af miljøforbindelser som lipidhovedgruppe. Kredit:Marten Exterkate, Universitetet i Groningen Cel -
 Kemikere skaber ny krystalform for insekticid, øger dets evne til at bekæmpe myg og malariaNew York University-forskere har skabt en ny krystalform af deltamethrin - et almindeligt insekticid, der bruges til at kontrollere malaria - hvilket resulterer i et insekticid, der er op til 12 gange
Kemikere skaber ny krystalform for insekticid, øger dets evne til at bekæmpe myg og malariaNew York University-forskere har skabt en ny krystalform af deltamethrin - et almindeligt insekticid, der bruges til at kontrollere malaria - hvilket resulterer i et insekticid, der er op til 12 gange -
 Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…En faktor, der holder den udbredte brug af miljøvenlige brintbrændselsceller tilbage i biler, lastbiler og andre køretøjer er prisen for de platinkatalysatorer, der får cellerne til at fungere. En til
Ny, holdbar katalysator til nøglebrændstofcellereaktion kan vise sig nyttig i miljøvenlige køret…En faktor, der holder den udbredte brug af miljøvenlige brintbrændselsceller tilbage i biler, lastbiler og andre køretøjer er prisen for de platinkatalysatorer, der får cellerne til at fungere. En til -
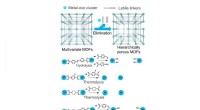 Strategier til at generere større porer i metal-organiske rammerIntroduktion af mesoporer i mikroporøse multivariate MOFer ved selektivt at fjerne labile linkere gennem hydrolyse, termolyse og ozonolyse. Gengivet fra Chem. Soc. Rev., 2019, 48, 4823-4853 med tillad
Strategier til at generere større porer i metal-organiske rammerIntroduktion af mesoporer i mikroporøse multivariate MOFer ved selektivt at fjerne labile linkere gennem hydrolyse, termolyse og ozonolyse. Gengivet fra Chem. Soc. Rev., 2019, 48, 4823-4853 med tillad
- Hvad er hydrogenperoxid opdelt i?
- Fysikere demonstrerer topologisk superledning på palladiumdibismuthider
- Forskere opdager radioekkoer af et sort hul, der lever af en stjerne
- Hvad er kraft med hensyn til fysisk videnskab?
- Beskriv tre horisonter af en resterende jord?
- Hvad har stoffer med lige gennemsnitlige kinetiske energier lige?


