Hvorfor har svovl og ilt forskellige kemiske egenskaber?
1. Elektronisk konfiguration:
* ilt: Oxygen har den elektroniske konfiguration 1S² 2s² 2p⁴. Det har seks valenselektroner (elektroner i den yderste skal), hvilket gør den meget elektronegativ og ivrig efter at få to elektroner for at opnå en stabil oktetkonfiguration.
* svovl: Svovl har den elektroniske konfiguration 1S² 2s² 2p⁶ 3S² 3P⁴. Det har også seks valenselektroner, men de er i et højere energiniveau (3p) sammenlignet med ilt. Dette gør svovl mindre elektronegativ end ilt.
2. Atomstørrelse:
* ilt: Oxygen er et mindre atom end svovl med en mindre atomradius. Dette gør Oxygen's valenselektroner mere tæt holdt af kernen, hvilket fører til højere elektronegativitet.
* svovl: Svovl er et større atom med en større atomradius. Dens valenselektroner er længere væk fra kernen og oplever således svagere tiltrækning, hvilket resulterer i lavere elektronegativitet.
3. Ioniseringsenergi:
* ilt: Oxygen har en højere ioniseringsenergi end svovl, hvilket betyder, at det kræver mere energi for at fjerne et elektron fra dets yderste skal. Dette skyldes den mindre størrelse og stærkere tiltrækning mellem kernen og valenselektronerne.
* svovl: Svovl har en lavere ioniseringsenergi på grund af dens større størrelse og svagere tiltrækning mellem kernen og valenselektroner.
4. Oxidation siger:
* ilt: Oxygen udviser typisk oxidationstilstande på -2, selvom det også kan have andre oxidationstilstande som -1 i peroxider.
* svovl: Svovl udviser en bredere række oxidationstilstande fra -2 til +6. Dette skyldes, at dens valenselektroner er længere væk fra kernen og kan deltage i en større række bindingsinteraktioner.
5. Reaktivitet:
* ilt: Oxygen er et meget reaktivt element på grund af dets stærke elektronegativitet og tendens til at få to elektroner til dannelse af stabile oxider.
* svovl: Svovl er mindre reaktiv end ilt, men danner stadig forbindelser med forskellige elementer, såsom sulfider og sulfater.
6. Bindingspræferencer:
* ilt: Oxygen danner let dobbeltbindinger (O =O i O₂) og deltager i hydrogenbinding.
* svovl: Svovl danner enkeltbindinger lettere (S-S i S₈) og kan danne flere bindinger, men med mindre frekvens end ilt.
Disse forskelle i elektronisk konfiguration, atomstørrelse, ioniseringsenergi, oxidationstilstande, reaktivitet og bindingspræferencer resulterer i de forskellige kemiske egenskaber, der er observeret mellem ilt og svovl.
 Varme artikler
Varme artikler
-
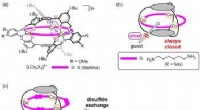 Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere
Et lukket burlignende molekyle, der kan åbnesFig.1 Oprindeligt lukket molekylærbur (til venstre). Disulfidbindinger kan brydes via reaktioner med thiolatanioner, resulterer i dannelse af åbninger (højre). Kredit:Kanazawa University Forskere -
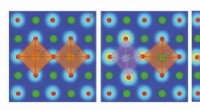 Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f
Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f -
 Bærbar elektronik til kontinuerlig hjerte, respirationsovervågningEn lille og billig sensor, annonceret i Applied Physics Letters og baseret på et elektrokemisk system, kan potentielt bæres uafbrudt af hjertepatienter eller andre, der kræver konstant overvågning. Hø
Bærbar elektronik til kontinuerlig hjerte, respirationsovervågningEn lille og billig sensor, annonceret i Applied Physics Letters og baseret på et elektrokemisk system, kan potentielt bæres uafbrudt af hjertepatienter eller andre, der kræver konstant overvågning. Hø -
 Store molekyler fra kostfibre kan ændre tarmmiljøet gennem fysiske kræfterKredit:CC0 Public Domain Store molekyler fra kostfibre, kaldet polymerer, kan fysisk påvirke miljøet i tyndtarmen ved at få faste partikler til at gruppere sig (eller aggregere), ifølge forskning
Store molekyler fra kostfibre kan ændre tarmmiljøet gennem fysiske kræfterKredit:CC0 Public Domain Store molekyler fra kostfibre, kaldet polymerer, kan fysisk påvirke miljøet i tyndtarmen ved at få faste partikler til at gruppere sig (eller aggregere), ifølge forskning
- Er det en kemisk eller fysisk forandring at blande jod og bagepulver?
- Hvad er den kemiske ligning for sojalecithin?
- Hvad er den type uoverensstemmelse, hvorpå der findes en erosionsoverflade, et adskillige vandrette…
- Hvordan vil du beskrive et økosystem?
- Mere effektiv adskillelse af metan og CO2
- Hvordan er solhverv og jævndøgn relateret til positionen af jordens akse?


