Hvad er processen for metaller, der fjerner ilt fra metaloxid?
Her er en sammenbrud af processen:
1. Reaktionen:
Den generelle ligning for reduktion af et metaloxid er:
metaloxid + metal → metal + metaloxid
For eksempel kan reduktionen af jernoxid (FEO) med kulstof (C) repræsenteres som:
Feo + C → Fe + Co
2. Elektronoverførsel:
Metallet (i dette tilfælde, kulstof) fungerer som et reduktionsmiddel , donerer elektroner til metaloxidet.
* carbon mister elektroner og oxideres, danner kulilte (CO).
* jernoxid får elektroner og reduceres, danner elementært jern (Fe).
3. Termodynamik:
Reduktionsprocessen udføres ofte ved høje temperaturer, hvilket giver den nødvendige energi til, at reaktionen kan forekomme. Dette skyldes, at processen typisk involverer at bryde kemiske bindinger i metaloxidet.
4. Ansøgninger:
Metalreduktion er en afgørende proces i mange industrielle anvendelser, herunder:
* Metallurgi: Uddrag af metaller fra deres malm.
* Kemisk syntese: Producerer specifikke kemikalier.
* katalyse: Som et trin i forskellige katalytiske processer.
5. Eksempler:
Her er nogle almindelige eksempler på metalreduktionsprocesser:
* spaltovn: Bruges til at reducere jernmalm (fe₂o₃) til jernmetal. Coke (carbon) bruges som reduktionsmiddel.
* termitreaktion: En meget eksoterm reaktion, der bruger aluminium (AL) til at reducere jernoxid (Fe₂o₃) til smeltet jern.
I bund
Sidste artikelHvad er der ved type kemisk vejrforhold?
Næste artikelHvorfor har svovl og ilt forskellige kemiske egenskaber?
 Varme artikler
Varme artikler
-
 Østersskaller inspirerer til ny metode til at gøre superstærke, fleksible polymererEn figur, der illustrerer, at polymerkrystallisationshastighed kan bruges til at kontrollere den rumlige fordeling af nanopartikler. Urenheder (her, nanopartiklerne) vil blive opslugt af krystallen, h
Østersskaller inspirerer til ny metode til at gøre superstærke, fleksible polymererEn figur, der illustrerer, at polymerkrystallisationshastighed kan bruges til at kontrollere den rumlige fordeling af nanopartikler. Urenheder (her, nanopartiklerne) vil blive opslugt af krystallen, h -
 Hvordan katalysatorer i biler går dårligt, og hvorfor det er vigtigtKredit:CC0 Public Domain Moderne biler er afhængige af katalysatorer til at fjerne kulilte, kulbrinter og andre skadelige kemikalier fra udstødningsemissioner. For at gøre det er de afhængige af
Hvordan katalysatorer i biler går dårligt, og hvorfor det er vigtigtKredit:CC0 Public Domain Moderne biler er afhængige af katalysatorer til at fjerne kulilte, kulbrinter og andre skadelige kemikalier fra udstødningsemissioner. For at gøre det er de afhængige af -
 Påvisning af kræft fra udåndingKernen i dette nye ionmobilitetsspektrometer er en miniaturiseret FAIMS-chip. Kredit:Fraunhofer IPMS Den luft, vi udånder, indeholder information, der kan hjælpe med diagnosticering af sygdom. For
Påvisning af kræft fra udåndingKernen i dette nye ionmobilitetsspektrometer er en miniaturiseret FAIMS-chip. Kredit:Fraunhofer IPMS Den luft, vi udånder, indeholder information, der kan hjælpe med diagnosticering af sygdom. For -
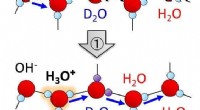 Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto
Unikke strukturelle udsving ved isoverfladen fremmer autoionisering af vandmolekylerSkematisk illustration af H/D isotopudvekslingsproces af vandmolekyler induceret af autoionisering og efterfølgende protonoverførsel. Kredit:NINS/IMS Vandis er et af de mest forekommende faste sto
- Hvad tjener ikke som et sted for blodcelleproduktion i det udviklende foster?
- NASA-NOAA satellit viser omfanget af Irmas-rester
- Astronauter vender tilbage efter marathon ISS -mission
- Hvor mange iltatomer har 1 mol O2 -gas?
- Den rolle religion spiller i adfærd på arbejdspladsen
- Forskere kæmper for at forhindre udslettelse af verdens koralrev


