Hvad mener du med polaritet i de kovalente bindinger?
Polaritet i kovalente obligationer:En simpel forklaring
Forestil dig en trækkraft mellem to lige så stærke mennesker. Hverken kan trække rebet helt mod deres side, og det forbliver i midten. Dette er som en ikke -polær kovalent binding , hvor to atomer deler elektroner lige.
Forestil dig nu, at den ene person er meget stærkere end den anden. Den stærkere person trækker rebet mere mod deres side, hvilket gør rebet ujævnt. Dette er som en polær kovalent binding , hvor det ene atom tiltrækker de delte elektroner stærkere end den anden.
Her er sammenbruddet:
* polaritet henviser til den ujævne fordeling af elektrondensitet i en kovalent binding.
* Elektronegativitet er et atoms evne til at tiltrække elektroner. Jo højere elektronegativitet, jo stærkere er trækket på de delte elektroner.
* Når to atomer med forskellige elektronegativiteter danner en binding, tilbringer elektronerne mere tid tættere på det mere elektronegative atom. Dette skaber en delvis negativ ladning (Δ-) på det mere elektronegative atom og A delvis positiv ladning (Δ+) på det mindre elektronegative atom.
Eksempler:
* vand (H₂O): Oxygen er mere elektronegativ end brint, så det trækker de delte elektroner tættere, hvilket skaber en delvis negativ ladning på ilt og en delvis positiv ladning på hvert brint. Dette gør vand til et polært molekyle.
* methan (ch₄): Carbon og brint har lignende elektronegativiteter, så de deler elektronerne temmelig jævnt. Dette gør metan til et ikke -polært molekyle.
Betydningen af polaritet:
Polaritet spiller en afgørende rolle i mange aspekter af kemi, herunder:
* opløselighed: Polære molekyler opløses i polære opløsningsmidler (som vand), mens ikke -polære molekyler opløses i ikke -polære opløsningsmidler (som olie).
* Kemiske reaktioner: Polaritet påvirker molekylernes reaktivitet og kan påvirke, hvordan de interagerer med hinanden.
* Biologiske processer: Polaritet er vigtig for mange biologiske processer, såsom proteinfoldning og membrantransport.
Sammenfattende polaritet i kovalente obligationer Beskriver den ujævne fordeling af elektrondensitet forårsaget af forskelle i elektronegativitet mellem atomerne. Dette har betydelige konsekvenser for egenskaber og opførsel af molekyler.
 Varme artikler
Varme artikler
-
 Kemikere afslører, hvordan tau-proteiner danner filtreMIT-kemikere har brugt nuklear magnetisk resonans (NMR) spektroskopi til at afsløre, hvordan to forskellige former af Tau-proteinet blandes for at danne filtrene, der ses i hjernen på Alzheimers patie
Kemikere afslører, hvordan tau-proteiner danner filtreMIT-kemikere har brugt nuklear magnetisk resonans (NMR) spektroskopi til at afsløre, hvordan to forskellige former af Tau-proteinet blandes for at danne filtrene, der ses i hjernen på Alzheimers patie -
 Boblefangst overflade hjælper med at slippe af med skumI to identiske bægerglas med en konstant strøm af bobler, ved at indsætte et stykke af det nye teksturerede materiale, der er udviklet af MIT -teamet (til højre), får skumdannelsen i toppen af bæger
Boblefangst overflade hjælper med at slippe af med skumI to identiske bægerglas med en konstant strøm af bobler, ved at indsætte et stykke af det nye teksturerede materiale, der er udviklet af MIT -teamet (til højre), får skumdannelsen i toppen af bæger -
 Hummers underliv er lige så hårdt som industrigummiEn vildledende sej film beskytter hummerens mave, mens dyret smyger sig hen over den stenede havbund. Kredit:Massachusetts Institute of Technology Vend en hummer på ryggen, og du vil se, at unders
Hummers underliv er lige så hårdt som industrigummiEn vildledende sej film beskytter hummerens mave, mens dyret smyger sig hen over den stenede havbund. Kredit:Massachusetts Institute of Technology Vend en hummer på ryggen, og du vil se, at unders -
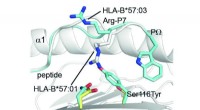 Forskere skinner lys over små peptidændringer, der påvirker immunsystemetMindre ændringer i HLA (Asp114Asn &Ser116Tyr) får identiske peptider til at antage forskellige former, når de er bundet til HLA. Kredit:Dr. Julian Vivian, Monash BDI. Humane leukocytantigen (HLA)
Forskere skinner lys over små peptidændringer, der påvirker immunsystemetMindre ændringer i HLA (Asp114Asn &Ser116Tyr) får identiske peptider til at antage forskellige former, når de er bundet til HLA. Kredit:Dr. Julian Vivian, Monash BDI. Humane leukocytantigen (HLA)
- WHO har ofte været under beskydning, men ingen nation har nogensinde flyttet for at bryde båndene …
- Hvad er en silikone -sag?
- Forklar arbejdsprincippet om vindkraft?
- Hvordan sammenligner forholdet mellem katodestråler, at anodestråler er?
- Er kinematikligninger kun brugt af fysikere og mennesker, der arbejder for NASA?
- Definere ordet teori i en videnskabelig forstand og derefter mere generel betydning?


