Forudsig og forklar hvilke af følgende systemer der er elektrisk ledere asolid naCl Bmolten kan vandig opløsning NaCl?
* solid NaCl: Ikke-ledere
* Forklaring: I fast NaCl holdes natrium (Na+) og chlorid (Cl-) -ioner tæt i et krystalgitter. De er ikke frie til at flytte og kan derfor ikke bære en elektrisk strøm.
* smeltet NaCl: dirigent
* Forklaring: Når NaCl smeltes, går de ioniske bindinger, og ionerne bliver frie til at bevæge sig. Disse mobile ioner kan bære en elektrisk strøm, når en spænding påføres, hvilket gør smeltet NaCl til en god leder.
* vandig løsning af NaCl: dirigent
* Forklaring: Når NaCl opløses i vand, adskiller den sig til Na+ og Cl- ioner. Disse ioner er omgivet af vandmolekyler og kan bevæge sig frit gennem opløsningen. Denne mobilitet tillader løsningen at udføre elektricitet.
Kortfattet:
* Nøglen til elektrisk ledningsevne i ioniske forbindelser er mobilitet af ioner .
* Solid NaCl har ioner i et fast gitter, så det udføres ikke.
* Molten NaCl og vandig NaCl har fri bevægende ioner, hvilket gør dem til gode ledere.
 Varme artikler
Varme artikler
-
 Forskere rapporterer teknik til at forlænge levetiden for perovskite solcellerKredit:Vytautas Getautis et al. fra J. Mater. Chem. C, 2018, 6, 8874–8878 En gruppe kemikere ved Kaunas University of Technology (KTU), Litauen, sammen med fysikerne fra Vilnius University og det
Forskere rapporterer teknik til at forlænge levetiden for perovskite solcellerKredit:Vytautas Getautis et al. fra J. Mater. Chem. C, 2018, 6, 8874–8878 En gruppe kemikere ved Kaunas University of Technology (KTU), Litauen, sammen med fysikerne fra Vilnius University og det -
 Maskinlæringsassisteret molekylært design til højtydende organiske fotovoltaiske materialerBrug af maskinlæring til at hjælpe molekylært design. Kredit:Wenbo Sun, Videnskabens fremskridt, doi:10.1126/sciadv.aay4275 At syntetisere højtydende materialer til organisk fotovoltaik (OPVer), d
Maskinlæringsassisteret molekylært design til højtydende organiske fotovoltaiske materialerBrug af maskinlæring til at hjælpe molekylært design. Kredit:Wenbo Sun, Videnskabens fremskridt, doi:10.1126/sciadv.aay4275 At syntetisere højtydende materialer til organisk fotovoltaik (OPVer), d -
 Kemikere syntetiserer psykotrope forbindelser fra regnskovstræKredit:Scripps Research Institute Barken fra Galbulimima belgraveana-træet, der kun findes i fjerntliggende regnskove i Papua Ny Guinea og det nordlige Australien, har længe været brugt af oprindel
Kemikere syntetiserer psykotrope forbindelser fra regnskovstræKredit:Scripps Research Institute Barken fra Galbulimima belgraveana-træet, der kun findes i fjerntliggende regnskove i Papua Ny Guinea og det nordlige Australien, har længe været brugt af oprindel -
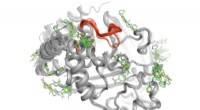 Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
Forskere opdager en måde at kigge inde i proteiner for at se, hvordan de er forbundetEn high-throughput-metode afslører, hvor over 100 små molekyler binder til proteinet PTP1B. Nogle få af disse bindingsområder kan sende signaler til det aktive sted (rødt) for at kontrollere PTP1Bs ak
- Hvordan er jordvidenskab og geologi forskellige?
- Atlas over ulighed udfordrer antagelser om rige og fattige områder
- Hvilke to kræfter kan få et objekt til at bevæge sig?
- Er tilbudskøb en familieegenskab?
- Er natriumsilikat det samme som aluminiumsilicat?
- Bangkok flyver med droner, advarer om strabadser i dårlig luftslag


