Hvad sker der, når du tilsætter kobbersulfat og kaliumhydroxid sammen?
1. reaktion:
Cuso₄ (aq) + 2koh (aq) → cu (OH) ₂ (s) + k₂so₄ (aq)
2. Forklaring:
* Kobbersulfat (cuso₄) er en opløselig ionisk forbindelse, hvilket betyder, at den opløses i vand til dannelse af kobber (II) -ioner (Cu²⁺) og sulfationer (so₄²⁻).
* Kaliumhydroxid (KOH) er også opløseligt, og danner kaliumioner (K⁺) og hydroxidioner (OH⁻) i opløsning.
* Når disse opløsninger er blandet, reagerer kobber (II) -ioner (Cu²⁺) med hydroxidionerne (OH⁻) for at danne kobber (II) hydroxid (Cu (OH) ₂), som er et blågrønt fast . Dette faste stof er uopløseligt i vand, så det udfælder ud af opløsningen.
* De resterende ioner, kalium (k⁺) og sulfat (SO₄²⁻), forbliver opløst i opløsningen som kaliumsulfat (k₂so₄).
3. observationer:
* Du vil observere en blågrøn bundfald dannes i løsningen.
* Løsningen bliver lidt overskyet som bundfaldet dannes.
Vigtig note: Denne reaktion er et eksempel på en dobbeltfortrængningsreaktion. Det er også et godt eksempel på, hvordan opløselighedsregler kan hjælpe med at forudsige, hvad der vil ske i en reaktion.
 Varme artikler
Varme artikler
-
 Mod at overvinde opløselighedsproblemer i organisk kemiUopløselige reaktanter er næppe reaktive i opløsning, men kan reagere i opløsningsmiddelfrie systemer ved hjælp af kugleformaling til at drive kemiske reaktioner i fast tilstand. Kredit:Tamae Seo, et
Mod at overvinde opløselighedsproblemer i organisk kemiUopløselige reaktanter er næppe reaktive i opløsning, men kan reagere i opløsningsmiddelfrie systemer ved hjælp af kugleformaling til at drive kemiske reaktioner i fast tilstand. Kredit:Tamae Seo, et -
 En lille cirkulær racerbane for lys kan hurtigt opdage enkelte molekylerEnkeltmolekylesensoren, forstørret 1, 700 gange på dette billede, er smallere end diameteren af det gennemsnitlige menneskehår. Lette løb rundt om ringen øverst. Kredit:Little Sensor Lab, University
En lille cirkulær racerbane for lys kan hurtigt opdage enkelte molekylerEnkeltmolekylesensoren, forstørret 1, 700 gange på dette billede, er smallere end diameteren af det gennemsnitlige menneskehår. Lette løb rundt om ringen øverst. Kredit:Little Sensor Lab, University -
 Ny enhed identificerer bloddonorer af høj kvalitetKredit:CC0 Public Domain Blodbanker har længe kendt til donorer af høj kvalitet - individer, hvis røde blodlegemer forbliver levedygtige i længere tid i opbevaring og i modtagerens krop. Nu viser
Ny enhed identificerer bloddonorer af høj kvalitetKredit:CC0 Public Domain Blodbanker har længe kendt til donorer af høj kvalitet - individer, hvis røde blodlegemer forbliver levedygtige i længere tid i opbevaring og i modtagerens krop. Nu viser -
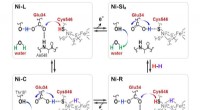 Mikroorganismer bygger de bedste brændstofeffektive brintcellerProtoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota For alle de fremsk
Mikroorganismer bygger de bedste brændstofeffektive brintcellerProtoner overføres mellem det aktive NiFe-sted og det omgivende protein gennem Cyt546- og Glu34-resterne under den katalytiske reaktion af [NiFe]-hydrogenase. Kredit:Shun Hirota For alle de fremsk
- Ny metode afslører mysteriet med langsomme elektroner
- Rumvandrende astronauter installerer bedre stationsbatterier
- Kan græsfrø vokse på en lavasten så godt som det kan vokse på soi
- Kæmper du med at få venner som voksen? Derfor bør du prøve at se til ældre generationer
- Elastisk polymer, der er både stiv og hård, løser mangeårige problemer
- Hvilke to planeter har den nærmeste længde på dagen?


